Approccio diagnostico alla paziente con Insufficienza Ovarica Primaria
Silvia Federici1,2, Luca Persani1,2, Marco Bonomi 1,2
1Dipartimento di Medicina Endocrino-Metabolica, IRCCS Istituto Auxologico Italiano, Milano, Italia 2Dipartimento di Biotecnologie Mediche e Medicina Traslazionale, Università degli Studi di Milano, Milano, Italia
Autore corrispondente:
Marco Bonomi, MD
Professore Associato di Endocrinologia Dipartimento di Biotecnologie Mediche e Medicina Traslazionale - Università degli studi di Milano Dipartimento di Medicina Endocrino-Metabolica – IRCCS Istituto Auxologico Italiano Ospedale San Luca – Piazzale Brescia 20 – 20149 Milano
Telefono: +39-02619112390 Fax: +39-02619113033
Email: [email protected]; [email protected]
Introduzione
L’insufficienza ovarica primaria (POI) è caratterizzata da un esaurimento dell’attività ovarica prima dei 40 anni, con conseguente ipoestrogenismo, amenorrea e infertilità [1,2]. In circa il 25% dei casi ed entro il primo anno di insorgenza, è possibile una ripresa intermittente dell’attività follicolare [3,4]. È una condizione caratterizzata da una forte suscettibilità genetica, che si presenta fino al 30% dei casi in forma familiare, la cui espressione è comunque modulata da diversi fattori ambientali [4,5]. Si tratta di un disordine eterogeneo, che può essere acquisito o congenito (Tabella 1), che tuttavia fino al 70-90% dei casi rimane idiopatico [4]. L’ipoestrogenismo prolungato può favorire l'insorgenza di osteoporosi, disturbi metabolici, cardiovascolari o neurologici [1,4]: recentemente la POI è stata infatti associata ad un significativo aumento di mortalità e morbidità [3]. La rilevanza di questa patologia è aumentata negli ultimi decenni per l’allungamento dell’aspettativa di vita e il sempre più frequente posticipo del primo concepimento oltre i 30 anni di età.
Pertanto, una diagnosi tempestiva ed un management adeguato sono fondamentali per la qualità di vita delle pazienti, per la riduzione delle complicanze e per garantire, quando possibile, una chance di preservazione della fertilità.
Presentazione clinica
La POI interessa circa l’1% delle donne sotto i 40 anni, con un’incidenza esponenzialmente crescente nelle diverse decadi [1-6]. La presentazione clinica più severa è rappresentata da assente sviluppo puberale e amenorrea primaria (PA), che nel 50% dei casi può essere associata a disgenesia ovarica. Tuttavia, nella maggioranza dei casi l’insorgenza dell’insufficienza ovarica avviene in epoca post-puberale, con amenorrea secondaria (SA) (eventualmente anticipata da irregolarità mestruali), infertilità e sintomi da ipoestrogenismo, generalmente più marcati da quelli tipici del climaterio [1-6]. La POI può anche associarsi a un quadro sindromico (Tabella 1).
Iter diagnostico
L’iter diagnostico della POI prevede inizialmente la conferma diagnostica, seguita dalla valutazione eziologica (Figura 1). La POI determina un ipogonadismo ipergonadotropo (estradiolo basso/indosabile e LH/FSH elevati). Sono stati raccomandati i seguenti criteri diagnostici: oligo/amenorrea per almeno 4 mesi, e un livello elevato di FSH >25 IU/l in due occasioni a distanza di più di 4 settimane (ESHRE) [6]. La riserva ovarica può essere valutata tramite ecografia ovarica con conta dei follicoli antrali (AFC) e la determinazione dell’ormone anti-mulleriano (AMH). Le ovaie risultano generalmente compatte e di dimensione ridotte e fin nel 50% dei casi di PA si può riscontrare una disgenesia gonadica con ovaie “a banderella”. L’AMH risulta basso/indosabile e, sebbene non ci siano ancora cut-off definiti per la diagnosi, risulta il marcatore attuale più sensibile di riserva ovarica [4]. Con la combinazione questi esami è possibile in qualche caso evidenziare una certa riserva ovarica, utile per il concepimento o la crioconservazione.
Una volta confermata la diagnosi di POI è importante effettuare indagini atte a stabilire la patogenesi, estremamente eterogenea (vedi Tabella 1). Escluse le cause acquisite tramite un’accurata anamnesi, vanno in primis ricercate cause autoimmuni e genetiche.
Il 4-30% delle POI ha un’origine autoimmune [4]. La ooforite autoimmune è particolarmente frequente in pazienti nelle sindromi polighiandolari autoimmuni di tipo 1, 2 o 3A, e può essere confermata dalla misurazione degli anticorpi anti-cellula steroidogenetica (SCA-Ab) o anti-21 idrossilasi (21OH-Ab) oppure, in caso di indisponibilità di questi dosaggi, può essere alternativamente supposta sulla base del quadro clinico in presenza di autoimmunità associata [3-5].
Tutte le donne che vanno incontro a POI prima dei 30 anni dovrebbero essere sottoposte alla valutazione del cariotipo [3-5], in quanto la sindrome di Turner si associa generalmente ad una insorgenza giovanile della POI. Va, inoltre, valutata la presenza di una pre-mutazione del gene FMR1 (associato a sindrome dell’X fragile nei maschi), in particolare nei casi di POI appartenenti a famiglie con maschi affetti da ritardo mentale [3-5]. La valutazione degli altri geni candidati della POI può essere effettuata mediante Next Generation Sequencing, con costi inferiori, rispetto al classico approccio per “gene candidato”, e con la possibilità di identificare difetti oligogenici, sempre più in grado di spiegare forme di POI finora “idiopatiche” [3,5].
L’eventuale identificazione del difetto genetico alla base della POI consente di predire il rischio di POI nelle giovani femmine della stessa famiglia, permettendo di programmare la propriagravidanza in età giovanile o di provvedere alla criopreservazione degli oociti. Inoltre, nel caso diindividuazione di premutazioni di FMR1, è possibile predire il rischio di ritardo mentale X-linked neinascituri maschi della famiglia.
Per quanto riguarda gli esami strumentali (tabella 1) in particolare dei pNET come pure delleneoplasie surrenaliche è raccomandata l’esecuzione di RMN o TAC addome con mdc anche sedovrebbe essere preferita la RMN rispetto alla TAC onde evitare l’esposizione a radiazioni ionizzantivisto che tale esame deve essere ripetuto annualmente (6). In alternativa alla TAC o RMN addome viene raccomandata l’esecuzione dell’ecoendoscopica che ha maggior sensibilità nell’individuare lesioni del pancreas in particolare della testa e corpo.
La RMN ipofisi viene raccomandata ogni 3 anni per lo screening degli adenomi ipofisari che nella maggior parte dei casi sono non funzionanti e pertanto possono dare segno di sé per effetto compressivo sul chiasma ottico o nervi cranici in caso di grandi dimensioni. Per lo screening dei carcinoidi polmonari/timici dovrebbe essere eseguita una TC o RMN toracica ogni 1-2 anni a partire dai 15 anni.
Figura 1: Flow-chart diagnostica
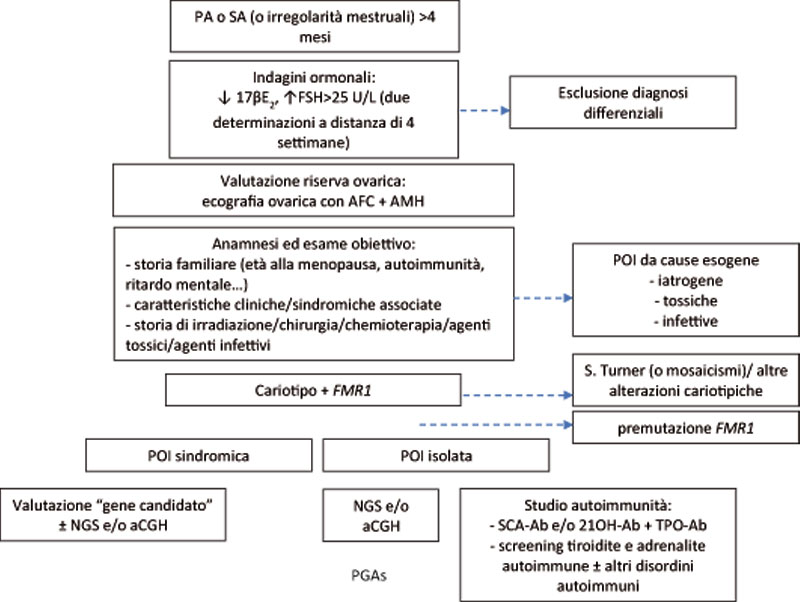 PA: amenorrea primaria; SA: amenorrea secondaria; 17βE2: 17βestradiolo; AFC: conta follicoli antrali; AMH: ormone anti-mulleriano; NGS: Next Generation Sequencing; aCGH: cariotipo molecolare/Array-CGH; SCA-Ab: anticorpi anticellula steroidogenetica; 21OH-Ab: anti-21 idrossilasi; TPO-Ab: anticorpi anti-Tireoperossidasi
Conflitti di interesse
PA: amenorrea primaria; SA: amenorrea secondaria; 17βE2: 17βestradiolo; AFC: conta follicoli antrali; AMH: ormone anti-mulleriano; NGS: Next Generation Sequencing; aCGH: cariotipo molecolare/Array-CGH; SCA-Ab: anticorpi anticellula steroidogenetica; 21OH-Ab: anti-21 idrossilasi; TPO-Ab: anticorpi anti-Tireoperossidasi
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione
umana
Studi sugli animali Gli autori non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Nelson LM. Clinical practice. Primary ovarian insufficiency. N Engl J Med. 2009 Feb 5;360(6):606-14. doi: 10.1056/NEJMcp0808697. PMID: 19196677; PMCID: PMC2762081.
- Welt CK. Primary ovarian insufficiency: a more accurate term for premature ovarian failure. Clin Endocrinol (Oxf). 2008 Apr;68(4):499-509. doi: 10.1111/j.1365-2265.2007.03073.x. Epub 2007 Oct 29. PMID: 17970776.
- Huhtaniemi I, Hovatta O, La Marca A, et al. Advances in the Molecular Pathophysiology, Genetics, and Treatment of Primary Ovarian Insufficiency. Trends Endocrinol Metab. 2018 Jun;29(6):400-419. doi: 10.1016/j.tem.2018.03.010. Epub 2018 Apr 26. PMID: 29706485.
- Panay N, Anderson RA, Nappi RE, et al. Premature ovarian insufficiency: an International Menopause Society White Paper. Climacteric. 2020 Oct;23(5):426-446. doi: 10.1080/13697137.2020.1804547. Epub 2020 Sep 8. PMID: 32896176.
- Rossetti R, Ferrari I, Bonomi M, et al. Genetics of primary ovarian insufficiency. Clin Genet. 2017 Feb;91(2):183-198. doi: 10.1111/cge.12921. Epub 2016 Dec 12. PMID: 27861765.
- European Society for Human Reproduction and Embryology (ESHRE) Guideline Group on POI, Webber L, Davies M, Anderson R, et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod. 2016 May;31(5):926-37. doi: 10.1093/humrep/dew027. Epub 2016 Mar 22. PMID: 27008889.
Scarica Articolo PDF




