I tumori ipofisari sono generalmente benigni, tuttavia raramente alcuni di essi dimostrano una spiccata aggressività biologica e clinica, ed una scarsa responsività ai trattamenti, richiedendo una complessa e articolata strategia di approccio terapeutico. Si definisce ‘aggressivo’ un tumore ipofisario invasivo, e/o rapidamente evolutivo, e/o recidivante nonostante terapia convenzionale multimodale. La prevalenza dei tumori ipofisari aggressivi (TIA), a causa della generica definizione, non è nota, con un intervallo tra la diagnosi iniziale e la potenziale manifestazione di aggressività del tumore da pochi mesi a più di 10 anni. I TIA si associano ad elevata morbidità e mortalità, sono prevalentemente macroadenomi o adenomi giganti, sebbene le dimensioni alla diagnosi non diano indicazione sul potenziale di aggressività del tumore, meglio definito dalla sua invasività, dalle caratteristiche istopatologiche e dalla evoluzione clinica inclusa la risposta alle terapie (1,2).
Caratterisitiche biologiche
L’invasività è classificabile sulla base dell’estensione anatomica del tumore nel seno sfenoidale e/o cavernoso, in accordo con la classificazione di Hardy (quelli più invasivi sono rappresentati dal grado III e IV, caratterizzati da erosione ossea focale o diffusa rispettivamente) o in base al coinvolgimento del seno cavernoso, secondo la classificazione di Knosp (il III e IV grado identificano le forme più invasive) (2). Tra gli elementi suggestivi di aggressività biologica del tumore, le informazioni istopatologiche e istochimiche sono di fondamentale rilevanza. L'ultima classificazione WHO 2017 degli adenomi ipofisari, identifica i seguenti istotipi come potenzialmente più a rischio di manifestare un comportamento più aggressivo: l'adenoma somatotropo scarsamente granulato, il macroadenoma lattotropo negli uomini, l'adenoma a cellule di Crooke, l'adenoma corticotropo silente e l'adenoma pluriormonale Pit-1-positivo (3). Il fenotipo potenzialmente aggressivo è definito inoltre dall'elevata espressione degli indici di proliferazione (Ki67 e conta mitotica), e dalla iperespressione della proteina p53.
Tra i biomarkers potenzialmente associati a maggiore aggressività si annoverano anche l'alterata espressione dei fattori di crescita dei fibroblasti e dei loro recettori (come l’FGFR4), delle metalloproteinasi, aberrazioni cromosomiche incluse la perdita della regione 11p e/o 11q, l'alterata espressione del gene PTTG e l'alterata espressione di alcuni miRNA. Nel 2013 Trouillas et al. hanno proposto una classificazione clinico-patologica distinguendo un: grado 1, per i tumori ipofisari non invasivi (1a, non invasivi e non proliferativi; 1b, non invasivi ma proliferativi); grado 2, invasivi (2a, invasivi ma non proliferativi; 2b, invasivi e proliferativi); e grado 3, metastatici. I tumori ipofisari di grado 2b, che più frequentemente andavano incontro ad una recidiva, presentavano un maggior rischio di sviluppare un comportamento aggressivo (4).
Genetica
Dal punto di vista genetico, è stato osservato che, rispetto ai tumori ipofisari sporadici, quelli associati ad una mutazione germinale causa di predisposizione familiare (come nella sindrome MEN1) hanno la tendenza ad avere un comportamento clinico più aggressivo In questo contesto è importante sottolineare come le mutazioni germline del gene AIP -responsabile di circa il 20% delle neoplasie ipofisarie che si sviluppano nell’ambito della sindrome Familial Isolated Pituitary Adenoma si possono associare a tumori ipofisari, specie GH e/o PRL secernenti, di maggiori dimensioni, più invasivi e meno responsivi alle terapie farmacologiche (1,2).
Terapie
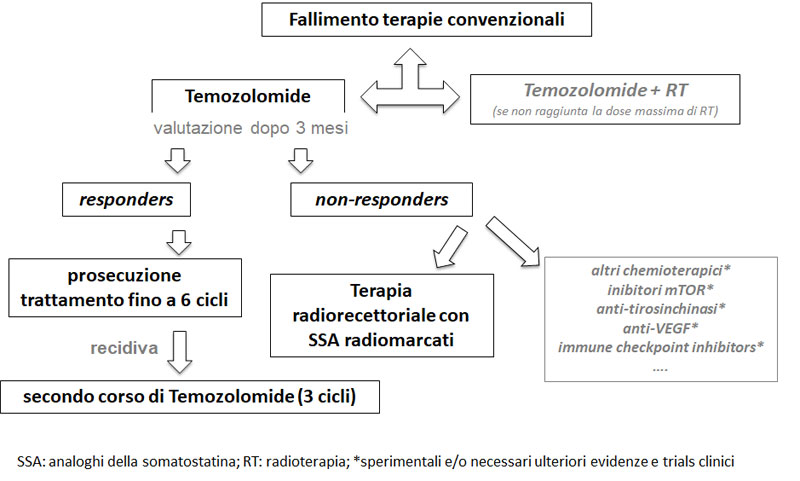
Nei pazienti con TIA dopo fallimento delle terapie tradizionali può trovare indicazione la chemioterapia con temozolomide (TMZ), agente alchilante orale, impiegato ad una dose di 150– 200 mg/m2 al giorno per 5 giorni ogni 28 giorni. Dopo tre cicli di terapia è indicata una rivalutazione dello stato di malattia, e in caso di risposta positiva il trattamento viene proseguito per un totale di 6 cicli (Figura 1). Il trattamento con TMZ è stato dimostrato essere efficace, in termini di risposta totale o parziale, in un 40% circa di casi, più frequentemente nei TIA non secernenti (1,2,5). Durante la terapia con TMZ è necessario valutare i parametri ematologici e di funzionalità epatica. Nel caso di recidiva dopo un primo trattamento efficace con TMZ, è possibile procedere ad un secondo corso di terapia con ulteriori 3 cicli di TMZ. Il ruolo predittivo della ridotta espressione tumorale di metilguanina metiltransefrasi (MGMT), proteina riparatrice del DNA, per la risposta al trattamento è controverso. Un approccio terapeutico con TMZ in modalità metronomica è stato proposto, ma non sono disponibili evidenze scientifiche comprovanti una maggiore efficacia o sicurezza. Una ulteriore opzione terapeutica, proposta in casi selezionati, quali i TIA che esprimono recettori per la somatostatina, è rappresentata dalla terapia radiorecettoriale (PRRT) con analoghi della somatostatina radiomarcati (177Lu, 90Y), che è risultata efficace in un terzo dei pochi casi riportati in letteratura, senza significativi effetti collaterali (1,2,6).
Altri approcci terapeutici sperimentali di seconda e terza linea, con inibitori del checkpoint immunitario, anticorpi anti-VEGF, anti-angiogenetici, inibitori delle tirosinchinasi e inibitori di mTOR, necessitano di ulteriori studi, evidenze e trials clinici che ne stabiliscano la reale efficacia e sicurezza (1,7).
Conclusioni
In conclusione, il complesso management dei TIA richiede un approccio multidisciplinare ritagliato
sulle caratteristiche di ogni singolo paziente tanto nella scelta delle sequenze terapeutiche che nel
follow-up..
 Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana
Studi sugli animali Gli autori non hanno eseguito studi sugli animali
Riferimenti Bibliografici




