

Il trattamento del carcinoma differenziato della tiroide si è basato, fino ad oggi, sulla tiroidectomia totale, seguita dall’ablazione del residuo post-chirurgico mediante la somministrazione di 131I e la terapia TSH soppressiva con L-T4. L’ablazione del residuo ha diverse finalità: i) l’eliminazione di tessuto tiroideo residuo che può nascondere altri microfocolai neoplastici (multifocalità), ii) la facilitazione della stadiazione precoce tramite la scintigrafia totale corporea post dose terapeutica di 131I, iii) il monitoraggio a lungo termine mediante il dosaggio della tireoglobulina circolante (Tg).
Tale pratica è certamente utile per facilitare follow up senza però che siano stata dimostrata una riduzione della frequenza di recidiva a medio/lungo termine né di riduzione della mortalità. Le linee guida ATA del 2015 (1) rivedono, modificando le precedenti, le indicazioni alla terapia radioablativa in base alla stratificazione del rischio che , nel basso rischio, non è più raccomandata.
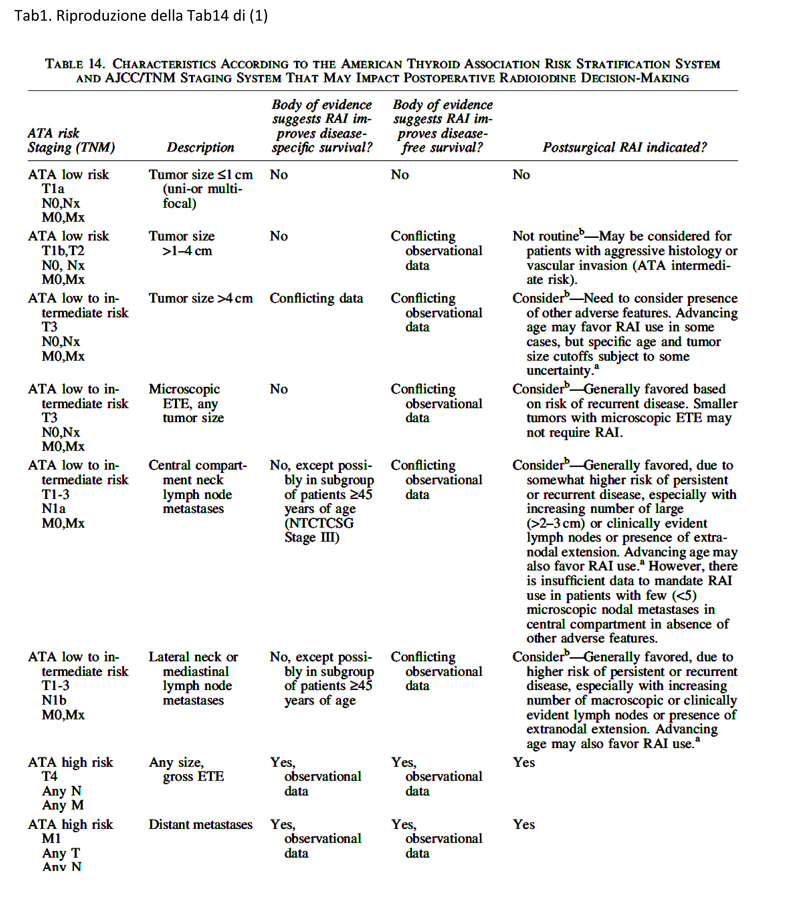
I pazienti a basso rischio includono, secondo le LG, quelli classificati come carcinomi T1a-T2, unimultifocali, variante non aggressiva, intratiroidei, senza invasione vascolare, N0 o N1 < 5 micrometastasi, e comprendono il carcinoma follicolare minimamente invasivo. Il quiz n 27 (2) della rubrica WeekEndo, on line su questo sito, per cui circa la metà degli utenti non ha preso in considerazione le raccomandazione delle LG, è infatti relativo ad un paziente a basso rischio, per i quali non è consigliata la radioablazione post chirurgica (Tab 1). La Tab.1 riproduce, per completezza, la Tab 14 del lavoro originale relativo alle LG ATA (1).
Secondo le LG, quindi, non c’è indicazione alla radioablazione in pazienti con carcinoma tiroideo classificato come basso rischio, in considerazione della bassa probabilità di persistenza/recidiva (tra 1% e 3%) e di mortalità cancro-correlata. Tale raccomandazione si basa sulle conclusioni della maggior parte di studi retrospettivi osservazionali disponibili che suggeriscono che la terapia radioablativa ha un impatto trascurabile sulla sopravvivenza libera da malattia in questo tipo di pazienti, in assenza di altri fattori di rischio (3-5).
E’ opportuno inoltre considerare che nei lavori di Mazzaferri degli anni 90 (6-7) in cui si dimostrava un impatto significativo della radio ablazione sia sul rischio di recidiva di malattia sia sulla sopravvivenza, i pazienti trattati e inclusi negli studi erano pazienti con carcinoma tiroideo con diametro minimo >1.5 cm ed erano pertanto nella maggior parte dei casi di stadio 2 o 3, cioè quelli che oggi definiremmo a “rischio intermedio”. Purtroppo, l’informazione derivata da questi studi è stata impropriamente applicata anche ai casi a basso rischio per i quali non esiste alcuna evidenza di un impatto della radioablazione sul’outcome della malattia. L’unico vero motivo per cui tale terapia può aver senso nel basso rischio è quello di facilitare il follow up e certamente in passato ciò poteva avere un senso poiché l’unico modo per identificare precocemente una eventuale
recidiva era la positivizzazione della Tg. Azzerarne il valore era quindi fondamentale per osservarne le variazioni nel tempo. Oggi, invece non è necessario ottenere l’azzeramento della Tg, peraltro tecnicamente difficile con gli attuali sistemi di dosaggio di Tg (hTg) ultrasensibili (8), considerando che la maggior parte delle recidive soprattutto dei casi a rischio basso e intermedio si verificano a livello del collo e sono quindi facilmente e precocemente identificabili con la ecografia(9).
Per tale motivo, per i pazienti a basso rischio non c’è indicazione alla terapia radiometabolica a scopo ablativo del residuo post chirurgico mentre, al fine di identificare precocemente quei rari casi di recidiva, ’è l’indicazione ad eseguire un monitoraggio con visita medica, ecografia del collo e controllo biochimico della hTg, ogni 12-18 mesi (1).
Bibliografia: