

1 Dipartimento di Medicina Sperimentale, Sapienza Università di Roma, Roma, Italia
2 Dipartimento di Psicologia, Sapienza Università di Roma, Roma, Italiat
Dati epidemiologici e numerosistudi hanno dimostrato una correlazione inversa tra durata, qualità del sonno e rischio di sviluppare obesità e diabete, a prescindere da età, sesso ed etnia. In pazienti con ridotta qualità (PoorSleepQuality-PSQ) o durata (Short SleepDuration-SSD) del sonno si riscontrano una minor perdita di peso ed un minor mantenimento del peso durante interventi nutrizionali1;la massa grassa totale e relativa e la massa grassa truncale è maggiormente rappresentata; durante un periodo di restrizione calorica, a parità di perdita di peso, si assiste ad una maggior perdita di massa magra e minor perdita di massa grassa rispetto ai soggetti con un sonno adeguato2,3; si riscontrano infine iperglicemia a digiuno, insulino resistenza e ridotta tolleranza glucidica4, 5.
In particolare, il poorsleep sembrerebbe responsabile di una cattiva regolazione del metabolismo glucidico5mentre lo short sleep risulta correlato con l’aumento del senso di fame, la ricerca di carboidrati e grassi eun aumento dell’introito energetico totale1. È importante notare che simili alterazioni della qualità e della durata del sonno si riscontrano in caso di Apnee Ostruttive del Sonno, che oltre ad essere conseguenza dell’obesità,rappresentano anche un fattore di rischio per un ulteriore incremento ponderale e per l’insorgenza di diabete1.
Non è ancora stato compreso appieno il nesso causale tra obesità, SSD e PSQ (fig 1)
La presenza di queste condizioni ha conseguenze comportamentali legate all’aumento della sonnolenza diurna, con una riduzione dell’attività fisica1.Si ha inoltre un aumento dell’introito alimentare7, probabilmente mediato da alterazioni dei livelli circolanti degli ormoni regolatori di fame e sazietà. In seguito ad una privazione di sonno, è stata riscontrata un’ipersecrezione ipotalamica di orexine, le quali sono implicate sia nel mantenimento dello stato di veglia ma anche nella regolazione dell’introito di cibo8.Ridotti livelli di leptina (“ormone della sazietà”) ed un aumento dei livelli dighrelina (“ormone della fame”) sono stati rilevati conseguentemente aSSD9, ma solo in alcuni studi ed una metanalisi del 20157conclude che non vi sono cambiamenti statisticamente significativi dei livelli di questi due ormoni in associazione a SSD. Sicuramente la diversità dei pattern alimentari ed i diversi stati di bilancio energetico dei pazienti sono influenti sulla secrezione degli ormoni regolatori della fame, ma questo ci suggerisce anchel’importanza deimeccanismi cerebrali di ricompensa edegliaspetti edonici che possono esercitare una spinta opposta a quella del controllo ormonale periferico della fame1. L’aumento dell’introito alimentare supera di gran lunga l’irrisorio aumento del dispendio energeticototale (4-5% in più, peraltro non statisticamente significativo secondo studi di metanalisi7) legato al costo aggiuntivo delle ore di veglia, esitando in un bilancio energetico positivo e, in cronico, in un incremento ponderale4.
Riguardo all’impatto della SSD sul metabolismo glucidico, indagini sui livelli plasmatici di cortisolo e sull’attività simpatica sono risultati inconcludenti, mentre recentemente è stato descritto un aumento degli acidi grassi non esterificati circolanti, notoriamente connessi alla resistenza insulinica10.
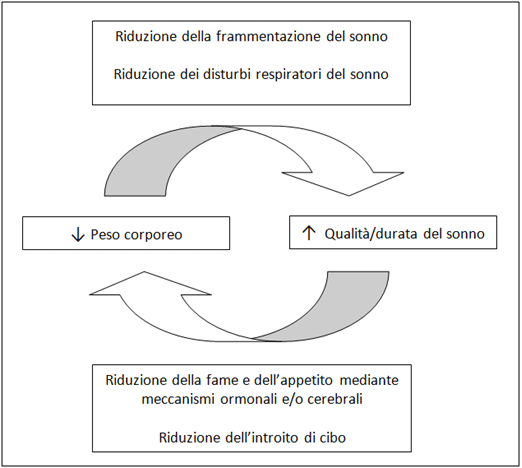
In conclusione, una particolare attenzione andrebbe dunque posta nella ricerca e nell’eventuale trattamento di PSQ/SSDin pazienti affetti da obesità e/o diabete mellito, al fine di ottenere un miglior controllo del peso e del metabolismo glucidico (fig 2)..
Figura 1: Possibile nesso causale tra ridotta qualità o durata del sonno e obesità/diabete (Riadattato da Nedeltcheva et al. CurrOpinEndocrinol Diabetes Obes 2014; 21: 293- 8.)
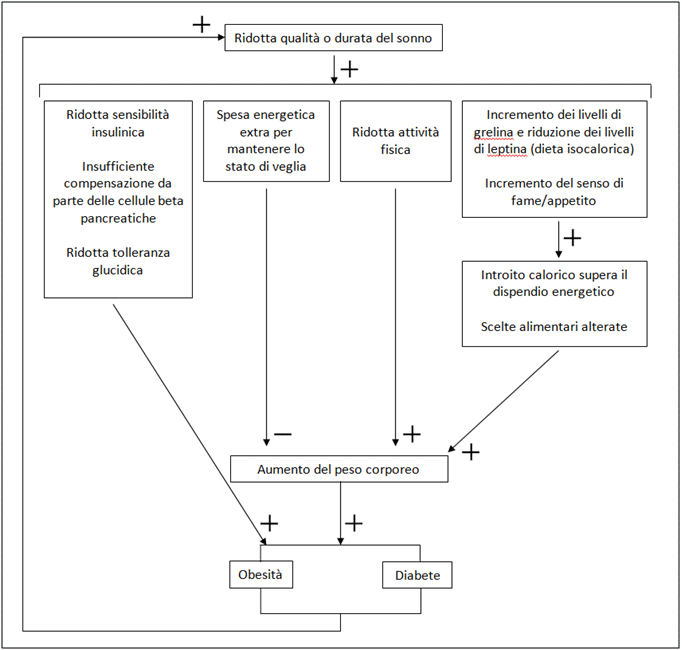
Figura 2: Strategia di intervento per contrastare l’obesità legata alla ridotta qualità/durata del sonno (Riadattato da St-Onge MP et al. HormMolBiolClinInvestig 2014; 17: 29- 37)
Riferimenti Bibliografici