Introduzione ed Epidemiologia
La tiroidite cronica linfocitaria o tiroidite di Hashimoto, di gran lunga più frequente del morbo di Graves-Basedow, controparte iperfunzionante dell’autoimmunità tiroidea, determina la graduale distruzione immuno-mediata del parenchima ghiandolare. Essa rappresenta la malattia autoimmune più diffusa al mondo, con una prevalenza stimata globale del 5%. In una percentuale che nei diversi studi è variabile tra il 15 ed il 30% dei casi, l’autoimmunità tiroidea si associa ad una o più malattie autoimmuni endocrine e no, determinando dei quadri sindromici di poliautoimmunità [1]. Le malattie autoimmuni endocrine che più frequentemente si associano all’autoimmunità tiroidea sono rappresentate dal diabete mellito di tipo 1, dal morbo di Addison e dall’insufficienza ovarica precoce [2]. Tra le malattie non endocrine, invece, si possono riscontrare patologie sistemiche (perlopiù malattie reumatologiche) od organospecifiche con una netta prevalenza delle auto immunopatie gastrointestinali e cutanee [1]. Recenti studi monocentrici hanno confermato che la gastrite cronica atrofica, la cui prevalenza nella popolazione generale si attesta al 2%, è la malattia autoimmune maggiormente associata all’autoimmunità tiroidea [3]. Essa può essere preceduta, accompagnata e/o innescata dalla frequente infezione da H. pylori. L’elevata associazione tra tiroidite cronica ed atrofia gastrica non è sorprendente, stante la comune derivazione embriologica, la progressiva distruzione dei tireociti come delle cellule parietali gastriche ed il comune ruolo patogenetico dei linfociti T CD4+ tramite la pathway Th1nei processi distruttivi delle due patologie [3].
Le somiglianze fra le patologie si evincono anche clinicamente dall’andamento indolente di entrambe, spesso silenti per anni. La riduzione della capacità ormono-secretiva della tiroide e la perdita ingravescente della capacità dello stomaco di produrre acido cloridrico e fattore intrinseco, con la comparsa delle rispettive forme di anemia micro e macrocitica, sono spesso gli unici segni rivelatori della coesistenza dei fenomeni auto aggressivi. Un segnale diagnostico precoce può essere rappresentato dalla positività degli specifici autoanticorpi (anti tireoperossidasi, anti-cellule parietali gastriche). Essi possono comparire precocemente nella tiroidite mentre possono essere tardivi nell’atrofia gastrica la cui età media di insorgenza si attesta fra i 50 ed i 70 anni. Gestione clinica.
La corretta gestione clinica del paziente con concomitante autoimmunità tiroidea e gastrica si basa sul riconoscimento diagnostico delle due auto immunopatie. A seguito della più semplice e precoce diagnosi di tiroidite cronica ed a fianco delle frequenti turbe dispeptiche, due sono le manifestazioni cliniche che devono indurre a sospettare la coesistenza dell’autoimmunità gastrica: l’anemia ed il malassorbimento di farmaci [4,5]. L’anemia è inizialmente microcitica sideropenica e refrattaria alla terapia marziale per os, differente perciò dalla forma normocitica che può caratterizzare anche pazienti con un deficit funzionale ghiandolare. Con il progredire dell’atrofia gastrica, il malassorbimento di micronutrienti determina un’anemia macrocitica, nota come anemia perniciosa, dovuta alla carenza di fattore intrinseco e quindi di vitamina B12 che, in questi fenotipi, è segno patognomonico [4]. Il dosaggio alterato della cianocobalamina eventualmente associato a quello della gastrina sierica e la positività degli anticorpi anti-cellule parietali gastriche consentono in questa fase un sospetto diagnostico forte che deve indurre alla conferma istologica mediante biopsie endoscopiche. L’atrofia gastrica è considerata una condizione precancerosa in virtù del fatto che predispone a diversi istotipi di neoplasie gastriche e la diagnosi ed il relativo follow up istologico sono pertanto raccomandati [3].
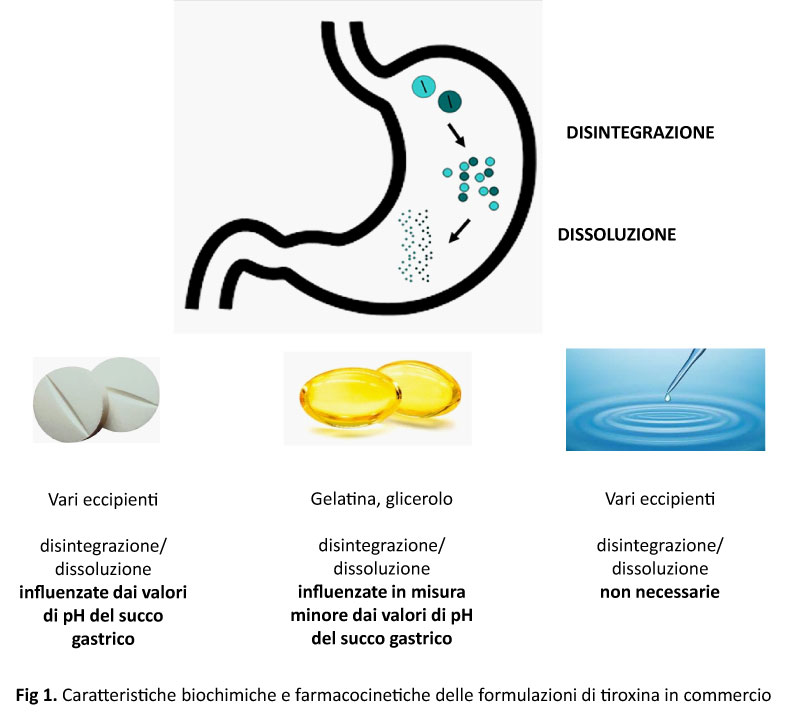
L’impatto dell’atrofia gastrica sulla gestione del paziente in terapia con Levo-tiroxina è stato ampiamente dimostrato poiché l’ipocloridria del succo gastrico incide negativamente sulla dissoluzione delle compresse di Levotiroxina, influenzane l’assorbimento. La conoscenza del meccanismo patogenetico del malassorbimento di tiroxina nei pazienti con alterazioni dell’acidità del succo gastrico ha portato la ricerca farmaceutica all’individuazione di nuove formulazioni di tiroxina, in capsule molli e liquida (Fig.1), in grado di garantire una migliore gestione terapeutica anche in questa categoria di pazienti [6]. A partire dal 2015 concordanti evidenze convergono sulla migliore efficienza delle capsule molli rispetto alla compressa di tiroxina, in pazienti con alterata secrezione gastrica di natura farmacologica, infiammatoria e/o patologica. A supporto di queste evidenze è stato dimostrato un miglior profilo di dissoluzione in vitro della formulazione in capsule molli a pH > 2.5, soglia massima di normalità del pH del succo gastrico umano. Un lavoro del 2016 ha dimostrato anche l’efficacia della formulazione liquida, che per definizione non richiede disaggregazione e dissoluzione, proprio nei pazienti affetti da gastrite cronica atrofica. La mancanza di lavori randomizzati e controllati ha impedito finora il supporto delle linee guida internazionali a queste formulazioni.
Conclusioni
La presenza di una concomitante auto immunopatia gastrica in pazienti con tireopatia autoimmune deve essere sospettata in presenza di anemia refrattaria o in caso di aumentato fabbisogno di tiroxina da causa ignota. La corretta diagnosi consente non solo l’ottimizzazione del trattamento della tireopatia ma anche il follow-up di una condizione che conferisce un aumentato rischio di sviluppare di neoplasie dello stomaco..