Inquadramento diagnostico dell’Orbitopatia di Graves
Martina Verrienti1, Ludovica Aliberti1, Luisa Valente2, Carla Enrica Gallenga3, Luca Borgatti4, Maria Chiara Zatelli1, Maria Rosaria Ambrosio1
1Sezione di Endocrinologia, Geriatria e Medicina Interna, Dipartimento di Scienze mediche, Università di Ferrara, Ferrara, Italia
2U.O. Chirurgia Maxillo-Facciale, Dipartimento di Chirurgie Specialistiche, Azienda Ospedaliero Universitaria di Ferrara, Ferrara, Italia
3U.O. Clinica Oculistica, Dipartimento di Chirurgie Specialistiche, Azienda Ospedaliero Universitaria di Ferrara, Ferrara, Italia
4Unità di Neuroradiologia, Dipartimento di Radiologia, Azienda Ospedaliero Universitaria di Ferrara, Ferrara, Italia. Autore Corrispondente:
Autore Corrispondente:
Prof.ssa Maria Rosaria Ambrosio
Via Aldo Moro, 44124 Ferrara FE
Tel.: 0532/236517, FAX: 0532/236514
E-mail: [email protected]
Introduzione
L’Orbitopatia di Graves (GO) è la principale manifestazione extratiroidea del morbo di Graves ma si può verificare anche in pazienti con eu-/ipotiroidismo nell’ambito di una tireopatia autoimmune (0.2–11.0% di tutti i casi di GO) [1].
In Europa la prevalenza di GO è di ~8-15/10.000 abitanti [1]. La GO colpisce più spesso il sesso femminile (ratio ~3:1) e insorge tipicamente attorno ai 40-50 anni di età, con maggiore severità in età avanzata [2].
La presentazione clinica è eterogenea: il 65-72% dei casi si presenta con forme lievi; più rari sono i quadri che mettono a rischio la vista (“sight-threatening”, 2%), che comprendono l’ulcera corneale e la neuropatia ottica distiroidea (DON)[1].
Nella maggior parte dei casi l’orbitopatia è bilaterale e simmetrica, ma sono riscontrabili anche forme unilaterali o asimmetriche [2].
La gestione della GO richiede un approccio multidisciplinare e pone le sue basi su un appropriato e individualizzato inquadramento diagnostico della patologia.
Fattori di rischio
La valutazione endocrinologica parte dall’anamnesi, volta a valutare la presenza di fattori di rischio di GO, alcuni immodificabili (età, genere, genetica, familiarità per patologie autoimmuni), altri modificabili (fumo di sigaretta, disfunzione tiroidea, trattamento con radioiodio, stress ossidativo e ipercolesterolemia). I fattori modificabili devono essere corretti al fine di migliorare l’outcome del paziente [2].
È noto, inoltre, come gli anticorpi anti-recettore del TSH (TRAb) siano coinvolti nella patogenesi della GO e il loro titolo correli con presenza, attività e severità di malattia [2].
Strumenti diagnostici
La valutazione clinica è volta a definire la severità e l’attività di malattia mediante l’utilizzo di scores clinici standardizzati, raccomandati dalle attuali linee guida EUGOGO [3].
I sintomi di GO possono includere visus offuscato o ridotto, sensazione di corpo estraneo, fotofobia, epifora, discomfort retroculare, dolore al movimento oculare e diplopia (transitoria, costante o intermittente).
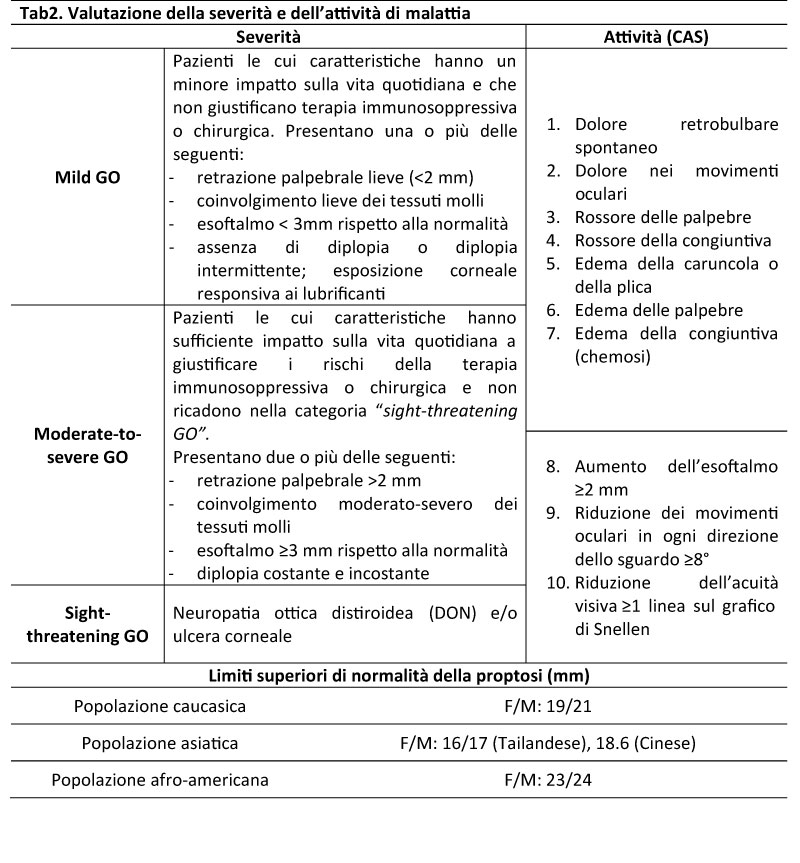
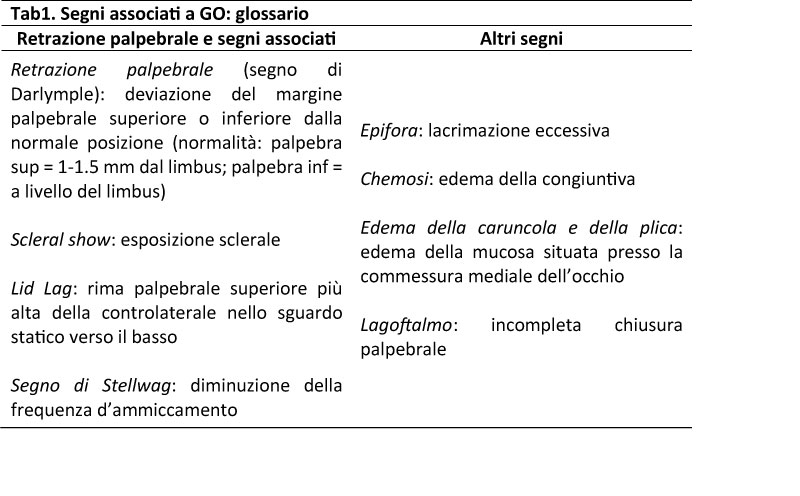
L’esame obiettivo (Fig1) permette di valutare il coinvolgimento dei tessuti molli (proptosi, edema sovra/sottorbitario, della plica e della caruncola, iniezione congiuntivale, eritema palpebrale, chemosi), il grado di retrazione palpebrale e segni associati (Tab1), l’eventuale presenza di lagoftalmo e di strabismo. Il grado di proptosi si misura tramite l’esoftalmometro di Hertel che rileva in mm la prominenza dell’apice corneale rispetto al canto laterale dell’occhio. L’utilizzo di atlanti fotografici riduce la soggettività della valutazione clinica nei pazienti con GO [5].
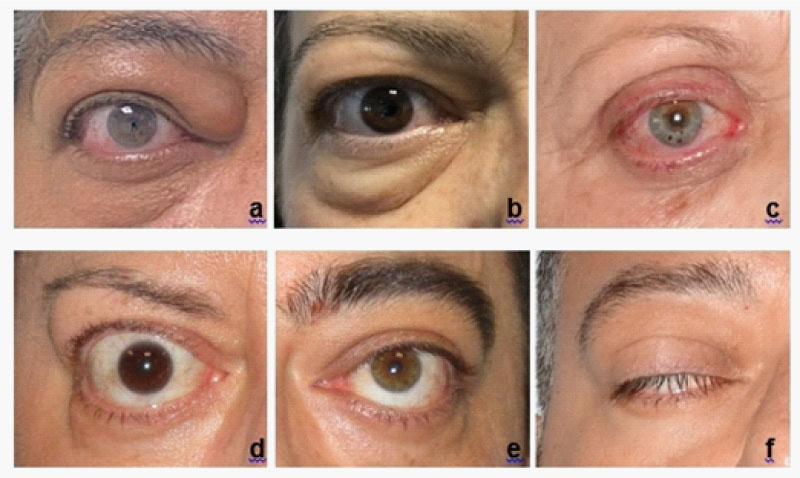
Il Clinical Activity Score (CAS) definisce l’attività di malattia [3]. Esso consta di 7 items, la presenza di almeno 3 dei quali è indicativa di GO attiva; 3 items aggiuntivi sono invece utilizzati per stabilire progressi o peggioramenti in corso di follow-up (Tab2)[3].
Il grado di severità di malattia è classificato secondo EUGOGO nelle categorie riportate in Tab2, in base al coinvolgimento dei tessuti molli, al grado di esoftalmo e di retrazione palpebrale, alla presenza di diplopia e all’impatto della GO sulla qualità di vita [3]. A tal proposito, è indicata la somministrazione del questionario GO-QoL, che valuta la funzione visiva e la percezione del proprio aspetto [3].
Gli esami di laboratorio devono includere la funzionalità tiroidea (TSH, FT4, FT3) e il dosaggio dei TRAb (possibilmente dopo diluizione) per definire la diagnosi e orientarsi sull’outcome del paziente [3]. La negatività dei TRAb, soprattutto dinanzi a quadri clinici meno frequenti (es: orbitopatia unilaterale), obbliga alla ricerca di cause alternative di flogosi orbitaria (Tab3) [4], ma non esclude la diagnosi di GO.
Raccomandata è la valutazione dei livelli sierici di colesterolo totale e LDL e l’eventuale terapia correttiva con statine [3].
L’imaging orbitario (MRi, CT) è utile a definire spessore muscolare, stato del nervo ottico, grado di proptosi e alterazioni quali-quantitative del tessuto adiposo retrorbitario, informazioni che non richiedono somministrazione di mdc. La MRi presenta maggiori vantaggi nella valutazione dell’edema (muscolare e del tessuto adiposo) e dell’eventuale sofferenza del nervo ottico ed è utile nella diagnosi differenziale della GO [6]. Lo studio CT (volumetrico ad alta risoluzione, completato con ricostruzioni multiplanari) è obbligatorio prima dell’intervento decompressivo, vista l’alta risoluzione della componente scheletrica [6]. Al fine di stabilire la presenza di apical crowding può essere calcolato l’indice di Barrett (su TC o RM): un valore ≥60% presenta alta sensibilità/specificità per DON.
L’ecografia orbitaria, invece, pur essendo di facile accessibilità, possiede minor accuratezza ed è operatore-dipendente; pertanto, risulta meno indicata nelle valutazioni comparative di follow-up.
La valutazione oculistica comprende lo studio di acuità visiva, fondo e tono oculare, cornea, grado di motilità oculare e diplopia (schermo di Hess-Lancaster). A completamento, lo studio della discriminazione dei colori, dei contrasti, dei potenziali evocati visivi e del campo visivo permette di individuare alterazioni precoci indicative di DON [5].
Conclusioni
La diagnosi della GO non può prescindere da un approccio multidisciplinare al fine di garantire la
miglior gestione di una malattia che impatta gravemente sulla qualità di vita.
Fig1. Quadri clinici tipici: a) e b) edema periorbitario; c) iperemia palpebrale e congiuntivale; d) retrazione della palpebra superiore e inferiore; e) scleral show; f) lagoftalmo
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana. Il consenso informato scritto è stato ottenuto per la pubblicazione di materiale fotografico a scopo di divulgazione scientifica.
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Perros P, Hegedüs L, Bartalena L et al. (2017) Graves' orbitopathy as a rare disease in Europe: a European Group on Graves' Orbitopathy (EUGOGO) position statement. Orphanet J Rare Dis 12,72 doi: 10.1186/s13023-017-0625-1
- Bartalena L, Piantanida E, Gallo D, Lai A, Tanda ML (2020) Epidemiology, Natural History, Risk Factors, and Prevention of Graves' Orbitopathy. Front Endocrinol (Lausanne) 11:615993 doi: 10.3389/fendo.2020.615993
- Bartalena L, Kahaly GJ, Baldeschi L, Dayan CM, Eckstein A, Marcocci C, Marinò M, Vaidya B, Wiersinga WM, & EUGOGO (2021) The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. Eur. J. of Endocrinol. 185(4), G43-G67 doi: 10.1530/EJE-21-0479
- Marinò M, Ionni I, Lanzolla G, Sframeli A, Latrofa F, Rocchi R, Marcocci C (2019) Orbital diseases mimicking graves’ orbitopathy: a long-standing challenge in differential diagnosis. J. of Endocrinol. Investig. 43(4):401-411 doi: 10.1007/s40618-019-01141-3
- Dickinson AJ, Perros P (2001) Controversies in the clinical evaluation of active thyroidassociated orbitopathy: Use of a detailed protocol with comparative photographs for
objective assessment. Clin. Endocrinol. 55(3):283-303. doi: 10.1046/j.1365- 2265.2001.01349.x
- Müller-Forell W, Kahaly G (2012) Neuroimaging of Graves' orbitopathy. Best. Pract. Res. Clin. Endocrinol. Metab. 26(3):259-71. doi: 10.1016/j.beem.2011.11.009.
Scarica Articolo PDF