Ipoparatiroidismo ipocalcemico. Approccio diagnostico-terapeutico.
Paola Salaris, Luca Deiana, Serena Piacentini
Mater Olbia Hospital srl, Olbia, Italia
Autore corrispondente Paola Salaris paola.[email protected]
c/o Mater Olbia Hospital Loc. Padrongianos, SS 125 Orientale Sarda +39 3497830290
Introduzione
Il paratormone (PTH) è l'ormone più importante nel regolare il metabolismo del calcio (con la vitaminaD) sia attraverso gli effetti diretti sull'osso e sul rene, sia attraverso gli effetti indiretti a livello del tratto gastroenterico.
L'ipoparatiroidismo (ipoPT) si verifica in presenza di distruzione delle paratiroidi (ad es. chirurgica, da carico di ferro – thalassemia/emocromatosi - o autoimmune), anomalia di sviluppo delle paratiroidi, della disregolazione della secrezione del PTH o azione deficitaria del PTH.
Quando la secrezione di PTH è insufficiente, compare l'ipocalcemia.
Cause
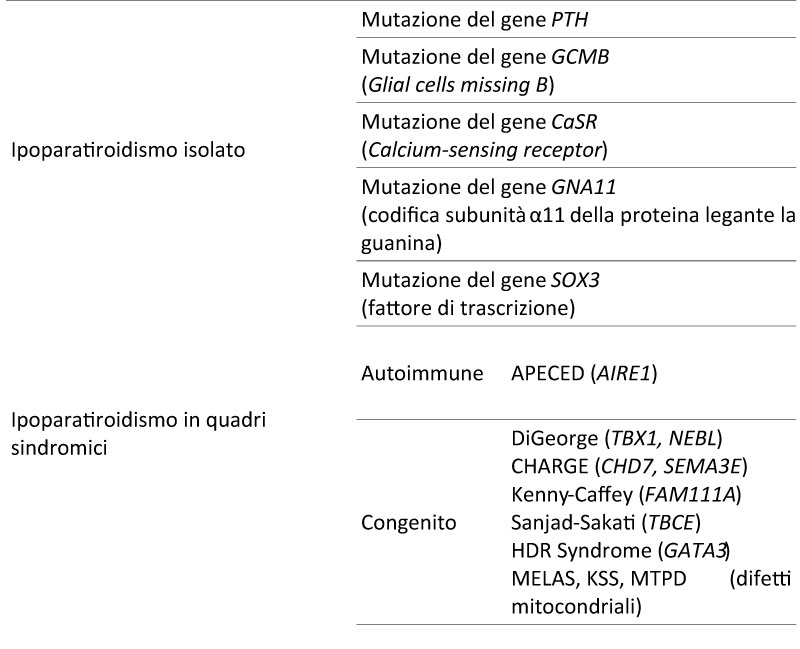
Negli adulti, la causa più comune di ipoPT è la chirurgia del collo, che provoca ~ 75% dei casi. Le cause non chirurgiche (genetiche, autoimmuni, idiopatiche o correlate all'ipomagnesiemia) costituiscono il restante 25% [1]. Cause genetiche possono essere isolate o far parte di quadri sindromici [tabella 1], tuttavia l'alterazione genetica rimane spesso sconosciuta.
Presentazione clinica
L'ipoPT dovrebbe essere sospettato nei pazienti con sintomi di eccitabilità neuromuscolare, lievi (formicolio periorale, parestesie alle estremità, crampi muscolari) o severi (tetania, laringospasmo, crisi epilettiche, disturbi del ritmo cardiaco), oppure in pazienti asintomatici con riscontro incidentale di ipocalcemia. Nel setting post-operatorio, la presentazione può essere acuta e severa.
Occorre sospettare cause genetiche se l'ipoPT insorge in età infantile, in presenza di storia familiare di ipoPT, consanguineità o autoimmunità, o se presenti altre endocrinopatie (malattia di Addison, insufficienza gonadica, diabete mellito, bassa statura e deformità ossee), disordini metabolici (come alcalosi ipokaliemica, acidosi lattica, dislipidemia) o non endocrini (anormalità congenite, palatoschisi, malattie cardiache, sordità, displasie urogenitali, immunodeficienza, candidiasi, stroke) [2]
Diagnosi
La diagnosi è confermata dalla misurazione simultanea di calcio sierico, albumina, magnesio, fosforo e PTH. Con alterati valori di albuminemia, è necessario correggere la calcemia per l'albumina con la seguente formula:
calcio corretto = calcio misurato+ [0.8×(4- albumina)]
oppure dosare il calcio ionizzato.
Ipocalcemia persistente con PTH basso o inappropriatamente normale sono, in assenza di ipomagnesiemia, virtualmente diagnostici di ipoPT.
Terapia
Ipocalcemia acuta
In caso di ipocalcemia acuta sintomatica si ricorrere alla somministrazione endovena calcio glucoconato, secondo il seguente schema:
Calcio gluconato 10% (circa 93 mg di calcio elementare/10 mL) in 50 mL di glucosata al 5% in 15 - 30 minuti).
Successivamente, procedere con infusione lenta di calcio gluconato pari a 0.5–1.5 mg/kg di peso corporeo/ora per ~ 8-10 ore, misurando la calcemia ogni 4-6 ore [3].
Ipocalcemia cronica
La terapia cronica dell'ipoPT ha l’obiettivo di evitare la comparsa di ipocalcemia sintomatica, mantenendo la calcemia nella parte bassa del range di normalità o appena al di sotto, tenendo valori di fosfato nei limiti della norma [3].
È necessario normalizzare sempre il magnesio qualora concomiti ipomagnesiemia. Altro importante obiettivo della terapia cronica è evitare l'ipercalciuria e l'iperfosfatemia, causa delle complicanze extra scheletriche (nefrocalcinosi, nefrolitiasi e insufficienza renale). La terapia convenzionale si avvale dei supplementi di calcio e vitaminaD. Generalmente sono richiesti 1-2 gr di calcio/die somministrati in dosi da 500 mg; tuttavia, ~ il 30% degli ipoPT necessitano di oltre 2 gr/die e fino a 10-12 gr in rari casi. Per motivi farmacocinetici il calcio carbonato è quello di più comune impiego; tuttavia, non è sempre ben tollerato poiché può determinare gonfiore e costipazione (in alternativa si può impiegare il calcio citrato).
Il calcitriolo è il metabolita della vitaminaD d'elezione poiché non richiede l'attivazione renale (mediata dal PTH), ha una rapida insorgenza di azione (ore) e un'emivita breve. Altri analoghi della vitaminaD utilizzabili sono l'α-calcidolo e il diidrotachisterolo.
Poiché l'emivita del calcitriolo è compresa fra 4-6 ore è meglio la doppia/tripla somministrazione giornaliera. Il dosaggio medio per il calcitriolo è tra 0,5 e 2 μg/die (nonostante possano rendersi necessari dosaggi più alti) [4]
Per prevenire l'ipercalciuria, è importante misurare periodicamente la calciuria delle 24h e ridurre le dosi di calcio e vitaminaD se elevata (≥300 mg in 24h). A tale scopo, alcuni pazienti richiederanno l'aggiunta di un diuretico tiazidico (come idroclorotiazide 12.5-50 mg 1-2 volte al dì).
Nell' ipoPT grave, quando la terapia convenzionale non è in grado di indurre eucalcemia ed è gravata da ipercalciuria persistente, dalla presenza di calcificazioni extra-scheletriche o da alterazioni della qualità della vita, è necessario valutare la terapia con PTH ricombinante. Attualmente sono disponibili il PTH umano ricombinante (1-84) e il PTH 1-34 (teriparatide).;
Tabella 1 Le principali cause genetiche di ipoparatiroidismo
 .
.
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Clarke BL (2018) Epidemiology and complications of hypoparathyroidism. Endocrinol Metab Clin North Am 47(4):771-782
- Clarke BL, Brown EM, Collins MT et al (2016) Epidemiology and Diagnosis of Hypoparathyroidism. J Clin Endocrinol Metab 101(6):2284-99
- John P Bilezikian (2020) Hypoparathyroidism. J Clin Endocrinol Metab 105(6): 1722–1736
- Tecilazich F, Formenti AM, Frara S et al (2018) Treatment of hypoparathyroidism. Best Pract Res Clin Endocrinol Metab 32(6):955-964
Scarica Articolo PDF




