Orbitopatia basedowiana gravissima: gestione della neurite ottica e delle lesioni corneali
Simone Donati1-3, Matilde Bartoccini2-3
1-Dipartimento di Medicina e Chirurgia, Università dell’Insubria, Varese. Italia; 2-Scuola di Specializzazione in Oftalmologia, Università di Brescia, Brescia, Italia; 3-Azienda Ospedaliero- Universitaria Ospedale di Circolo e Fondazione Macchi ASST Sette Laghi, Varese. Italia
Autore Corrispondente:Simone Donati e-mail: [email protected]
Introduzione
Il consensus statement EUGOGO del 2008 [1] classifica l’orbitopatia Basedowiana (GO), in base a severità di malattia e necessità di trattamento, in lieve (mild GO), moderata-severa (moderate-to-severe GO) e gravissima (sight-threatening GO) [Tabella 1]. Quest’ultima si identifica clinicamente nella neuropatia ottica distiroidea (DON) e nello scompenso corneale. Queste forme si presentano nel 3-5% dei pazienti affetti da GO e richiedono di essere diagnosticate e gestite prontamente con un trattamento medico ed eventualmente chirurgico, affinché la prognosi visiva non venga compromessa [2-3].
Neuropatia ottica distiroidea (DON)
In merito alla patogenesi, due sono le teorie accreditate. Nella gran parte dei casi la funzionalità nervosa risulterebbe compromessa dalla diretta compressione esercitata dai muscoli extraorbitari ipertrofici sul nervo ottico all’apice orbitario (apical crowding), mentre nel 5% dei casi la neuropatia sarebbe il risultato di uno stiramento del nervo ottico conseguente alla eccessiva proptosi (stretch optic neuropathy), in assenza di segni di ingombro muscolare dell’apice orbitario. Età avanzata, sesso maschile, disfunzione tiroidea e vasculopatia cronica secondaria a diabete, ipertensione e fumo, rappresentano fattori di rischio per lo sviluppo di DON. Il paziente lamenta calo visivo, discromatopsia e difetti del campo visivo accompagnati nel 50% dei casi da diplopia in posizione primaria o nello sguardo verso il basso, dolore orbitario persistente o associato al movimento di sguardo e disturbi da congestione dei tessuti molli con un CAS > 3 nella maggior parte dei casi [Tabella 2]; si osserva un difetto pupillare afferente (nei casi di patologia unilaterale o asimmetrica) e in oftalmoscopia la papilla può apparire normale o edematosa, più raramente pallida o congesta. In fase precoce sintomi e segni sono aspecifici ostacolando diagnosi e trattamento tempestivi. Gli esami strumentali sono di aiuto nel porre diagnosi in occasione di quadri subclinici. La perimetria, sebbene richieda la massima motivazione e collaborazione dell’esaminato e comporti frequentemente falsi positivi, mostra anormalità della visione periferica nel 70% dei pazienti; i pattern di compromissione del campo visivo sono aspecifici e comprendono scotoma paracentrale, scotoma arcuato incompleto, difetto altitudinale, nel 55% dei casi inferiore, e in generale una diminuzione della sensibilità retinica. I potenziali evocati visivi sono alterati nel 75% dei pazienti con ampiezza e latenza ridotte. Si tratta tuttavia di un esame non sempre disponibile e time-consuming. La tomografia a coerenza ottica (OCT) dimostra un progressivo assottigliamento dello strato delle fibre nervose retiniche e del complesso delle cellule ganglionari maculari, che sembra essere fortemente correlato a ridotta funzionalità e recupero visivi postoperatorio. L’ecodoppler retrobulbare può essere utile nella stima del flusso vascolare venoso orbitario, che nella miopatia restrittiva avanzata risulta sensibilmente ridotto, assente o invertito.
TC e RMN sono fondamentali per:
a) individuare fattori anatomici correlati allo sviluppo di neuropatia, quali fossa orbitaria stretta, bowing della lamina papiracea nei casi in cui il setto orbitario impedisca lo sviluppo di esoftalmo, aumento volumetrico eccessiva ipertrofia del retto mediale
b) per discriminarne natura compressiva o trazionale
c) per la pianificazione preoperatoria.
Nella forma compressiva gli esami radiologici mostrano l’aumento volumetrico dei muscoli estrinseci, in particolare di retto mediale e superiore per la prossimità al decorso nel nervo ottico a livello apicale, mentre nella forma trazionale la rettilineizzazione del nervo ottico e la deformazione del bulbo posteriore da un profilo tondo ad un profilo a V. Ulteriori reperti radiologici riscontrati nei casi di DON, seppur aspecifici, sono il prolasso del grasso intracranico attraverso la fessura orbitaria superiore, la dilatazione delle vene oftalmiche superiori e l’anteriorizzazione della ghiandola lacrimale.
La terapia del quadro clinico conclamato consiste nel trattamento medico immunosoppressivo e, in caso di insuccesso entro due settimane dell’avvio, la decompressione chirurgica urgente. Quest’ultima è indicata come approccio di prima linea nella sublussazione anteriore del globo oculare e recente comparsa di pieghe coroideali. Negli altri casi il trattamento steroideo rappresenta la terapia medica di prima scelta e prevede la somministrazione endovenosa di 500- 1000mg di metilprednisolone al giorno per 3 giorni consecutivi o a giorni alterni nel corso di una settimana. Tale schema è ripetibile a distanza di una settimana ed è efficace nel circa 40% dei pazienti. La dose cumulativa non deve superare gli 8 g a causa del rischio di insufficienza epatica acuta. Il trattamento steroideo è controindicato in caso di recente epatite virale, disfunzione epatica significativa, comorbidità cardiovascolare severa, disturbi psichiatrici, ipertensione e diabete non adeguatamente controllati. Si raccomanda protezione gastrica con iPP in particolare nei pazienti con altri fattori di rischio concomitanti e/o assunzione di FANS; la protezione della decalcificazione ossea in pazienti con fattori di rischio di osteoporosi e monitoraggio di enzimi epatici, glicemia, elettroliti e pressione arteriosa.
Persistenza di un CAS > 4 e/o nuovo calo visivo dopo miglioramento seguito a 2 settimane di trattamento steroideo rappresentano segni di cortico- resistenza.
La decompressione orbitaria si realizza ampliando gli spazi a livello della regione apicale attraverso la rimozione di parte delle pareti ossee orbitarie o in taluni casi con la riduzione del volume dei tessuti molli orbitari, nella fattispecie del tessuto adiposo extra-conale; è preferito l’approccio endoscopico trans-nasale perché garantisce accesso diretto al sito chirurgico. Nonostante le linee guida EUGOGO 2021 non specifichino quale intervento prediligere, associare la rimozione della parete mediale alle altre variabili chirurgiche contemplate dalla tecnica scelta, sembra garantire buoni risultati. Nel 84% dei casi la decompressione orbitaria è efficace nel ripristinare la visione centrale, indipendentemente da severità del calo visivo e ritardo di intervento e a lungo termine è vantaggiosa per la progressione della malattia orbitaria, riducendo congestione vascolare, esoftalmo e pressione intraorbitaria.
Le complicanze postoperatorie comprendono sanguinamento intraorbitario o intracranico, perdita visiva, leakage di fluido cerebrospinale, sinusite e temporanea disestesia nei territori di distribuzione della prima e seconda branca del nervo trigemino. Il tasso di progressione di diplopia arriva fino al 50% con poca possibilità di previsione, ma adeguatamente correggibile con lenti prismatiche e chirurgia dello strabismo. [4-8]
Scompenso corneale
Lo scompenso corneale è meno frequente rispetto la DON e occorre in meno del 2% dei pazienti. [9]
Il 65-85% dei pazienti affetti da GO lamenta secchezza oculare. Retrazione palpebrale, proptosi, lagoftalmo, ridotto fenomeno di Bell, per esposizione eccessiva della superficie corneale, alterazioni quantitative e qualitative a carico del film lacrimale, disfunzione di ghiandole lacrimali e di Meibonio concorrono al danno superficiale oculare che assieme alla ridotta sensibilità corneale per rarefazione del plesso nervoso predispongono l’insorgenza di cheratopatia. Clinicamente si manifesta con dolore e calo visivo, iperemia, chemosi congiuntivale e ulcerazione corneale che può progredire ad ascesso e assottigliamento corneale fino alla perforazione. L’eccessiva esposizione corneale deve essere trattata clinicamente e chirurgicamente con tecniche progressivamente più invasive, per scongiurare l’insorgenza o la recidiva dello scompenso corneale.
La terapia medica che prevede la frequente applicazione di lubrificanti topici, preferibilmente senza conservanti, e l’occlusione notturna, spesso risulta insufficiente a prevenire la progressione del danno corneale. In questi casi si ricorre ad altri presidi come apposizione di schermino corneale, camera umida, temporanea chiusura palpebrale con tarsorrafia o iniezione di tossina botulinica. In presenza di un quadro infettivo corneale si rende necessaria una terapia antibiotica. Terapia steroidea, seppur dibattuta, e decompressione chirurgica hanno un ruolo adiuvante quando le terapie sopradescritte sono inefficaci.
La perforazione corneale rappresenta un’emergenza chirurgica da trattare con colla, membrana amniotica e/o trapianto corneale.
Tabella 1
GO severity assessment according to EUGOGO
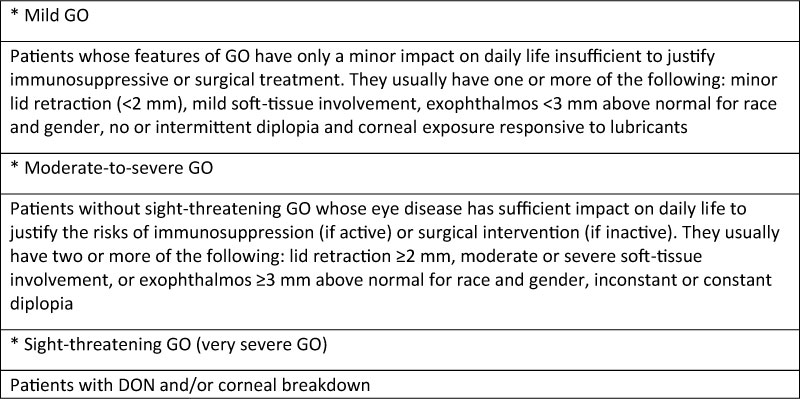 Tabella 2
Tabella 2
Assessment of GO activity and severity
GO activity assessment according CAS
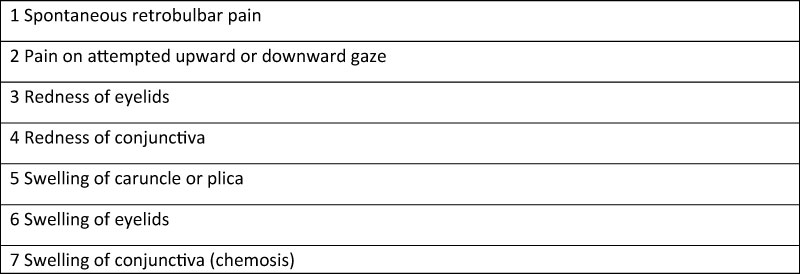 Tabella3
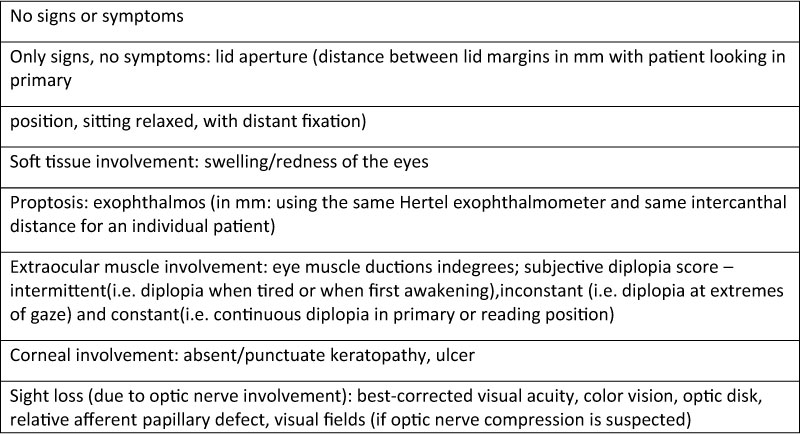
Tabella3
*Inactive GO = CAS <3 -* Active GO = CAS ≥3
GO severity assessment according to NOSPECS
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- “Standard italiani per la cura del diabete mellito 2018
AMD-Standard-unico1.pdf (aemmedi.it) uktimo accesso 22 giugno 2022
- Wong, V. W., Jalaludin, B. (2011) “Gestational diabetes mellitus: Who requires insulin therapy?,” Australian and New Zealand Journal of Obstetrics and Gynaecology, vol. 51, no. 5, pp. 432–436, Oct., doi: 10.1111/j.1479-828X.2011.01329.x.
- Bakiner, O., Bozkirli, E., Ozsahin, K., et al. (2013) “Risk Factors That can Predict Antenatal Insulin Need in Gestational Diabetes,” Journal of Clinical Medicine Research, doi: 10.4021/jocmr1515w.
- Mitra, S., Nayak, P.K., Sahoo, J., et al., (2014) “Predictors for antenatal insulin requirement in gestational diabetes,” Gynecological Endocrinology, vol. 30, no. 8, pp. 565–568, doi: 10.3109/09513590.2014.911274.
- Ducarme, G., Desroys du Roure, F., Grange, J., et al. (2019) “Predictive factors of subsequent insulin requirement for glycemic control during pregnancy at diagnosis of gestational diabetes mellitus,” International Journal of Gynecology and Obstetrics, vol. 144, no. 3, pp. 265–270, Mar., doi: 10.1002/ijgo.12753.
- M. Eleftheriades M., Chatzakis, C., Papachatzopoulou, et al. (2021) “Prediction of insulin treatment in women with gestational diabetes mellitus,” Nutrition and Diabetes, vol. 11, no. 1, Jun, doi: 10.1038/s41387-021-00173-0.
Scarica Articolo PDF






