Approccio diagnostico all’adenoma paratiroideo atipico
Elena Pardi1, Laura Mazoni1, Simona Borsari1, Liborio Torregrossa2, Filomena Cetani3
1Dipartimento di Medicina Clinica e Sperimentale, Università di Pisa, Pisa, Italia; 2Divisione di Patologia Chirurgica e 3U.O Endocrinologia 2, Azienda Ospedaliero Universitaria Pisana, Pisa, Italia
Per corrispondenza: Dr Elena Pardi Via Paradisa, 2 56124 Pisa Tel.: +39 050 995017
E-mail: [email protected]
Introduzione
L’iperparatiroidismo primario (IPP), terza endocrinopatia più frequente, è causato da neoplasie delle paratiroidi, nella maggior parte dei casi (circa 85%) adenomi (AP) o iperplasie (10-15%) a decorso benigno, 2-3% adenomi atipici (APA) e raramente (<1%) carcinomi (CP) [1].
L’APA è un tumore che presenta un potenziale maligno incerto, possedendo caratteristiche morfologiche, sia a livello macroscopico che microscopico, intermedie tra l’AP e il CP. All’esame istologico, in assenza di segni inequivocabili di crescita invasiva, non è possibile porre la diagnosi di CP secondo le linee guida proposte dalla WHO [2]. Il profilo clinico e biochimico dei pazienti con APA è più simile a quello dei pazienti con CP in quanto caratterizzato da un IPP con coinvolgimento osseo e renale, moderata ipercalcemia ed livelli elevati di PTH [3]. Tuttavia, al contrario dei pazienti con CP, la maggior parte dei pazienti con APA (96%) guarisce dopo intervento di resezione del tumore [4]. Risulta chiaro che riuscire a differenziare l’APA dagli altri due tipi di tumori presenti nell’IPP rappresenti un’importante sfida diagnostica per il clinico che dovrà indirizzare i pazienti più critici ad un endocrino chirurgo esperto. Il riscontro intra-operatorio di aderenze tessutali, interruzione della capsula, linfoadenopatia, suggeriscono al chirurgo l’opportunità di eseguire una resezione en bloc che prevede la rimozione, oltre alla ghiandola paratiroidea affetta, del lobo tiroideo ipsilaterale ed eventualmente dei tessuti adiacenti.
Ruolo diagnostico dell'istopatologia
L’esame macroscopico del tumore asportato evidenzia peso e dimensioni di norma superiori a quelli del AP, eventuali aspetti cistici, aree di necrosi o emorragia, capsula ispessita e aderenze ai tessuti circostanti. Tuttavia, in alcuni casi l’aspetto macroscopico è indistinguibile da quello degli AP.
I principali aspetti microscopici, variamente presenti nell’APA ma comuni nel CP, sono rappresentati da pattern di crescita solido-trabecolare, presenza di bande fibrose con/senza depositi di emosiderina, pleomorfismo cellulare e nucleare ed elevato indice mitotico. In alcuni casi, le bande fibrose possono intrappolare le cellule neoplastiche, simulando un’invasione capsulare denominata pseudo-capsulare (Fig. 1) [5]. In assenza di segni inequivocabili di malignità (infiltrazione neoplastica dei tessuti adiacenti, degli spazi perineurali e/o invasione vascolare) non è possibile porre la diagnosi di CP. Tuttavia, non c’è unanime consenso circa il numero minimo di aspetti istologici richiesti per fare una diagnosi univoca di APA [3].
I saggi di immunoistochimica utilizzati finora a scopo diagnostico con i marcatori attualmente in uso hanno mostrato una scarsa capacità nel differenziare i tumori che mostreranno un comportamento clinico più aggressivo da quelli con decorso benigno. La parafibromina, proteina codificata dal gene CDC73, rappresenta uno dei marcatori più specifici in grado di differenziare il PC dall’AP, in linea con la presenza di mutazioni del gene in circa l’80% dei PC. La perdita di espressione della parafibromina è infatti correlata alla comparsa di recidiva locale o metastasi a distanza ed elevato rischio di mortalità [4]. La parafibromina non si dimostra altrettanto specifica nell’APA, in quanto, nonostante sia positiva nella maggior parte dei casi, presenta un’ampia eterogeneità di risultati nei vari studi (0-50%). Un alto indice di proliferazione di Ki-67 (>5%) è spesso utilizzato come esame di supporto ed è associato a un aumentato rischio di PC. L’utilità diagnostica di Ki-67 nella diagnosi di APA è limitata per l’eterogeneità dei risultati nei vari studi, sebbene in oltre 80% degli APA, così come degli AP, i valori di positività siano <5% [4]. Altri marcatori quali galectina-3 e PGP 9.5, sovra-espressi nei PC, non sono stati sufficientemente validati da essere raccomandati a scopo diagnostico.
Ruolo diagnostico dell'analisi genetica
Mutazioni somatiche del gene oncosoppressore CDC73, riscontrate in oltre il 70% dei PC sporadici, sono poco comuni o assenti negli APA, così come negli AP [6]. Nonostante gli APA abbiano per lo più insorgenza sporadica, possono svilupparsi nell’ambito di IPP associato a disordini ereditari, quali sindromi delle neoplasie endocrine multiple di tipo 1 e 4, IPP associato ai tumori della mandibola (HPT-JT) e IPP familiare isolato (FIHP). Poiché mutazioni germinali di CDC73 sono presenti in circa il 90% dei pazienti con HPT-JT, e nel 7% di FIHP, l’analisi mutazionale di CDC73 dovrebbe essere condotta su un prelievo ematico del paziente con APA [4].
Iter di monitoraggio in caso di APA
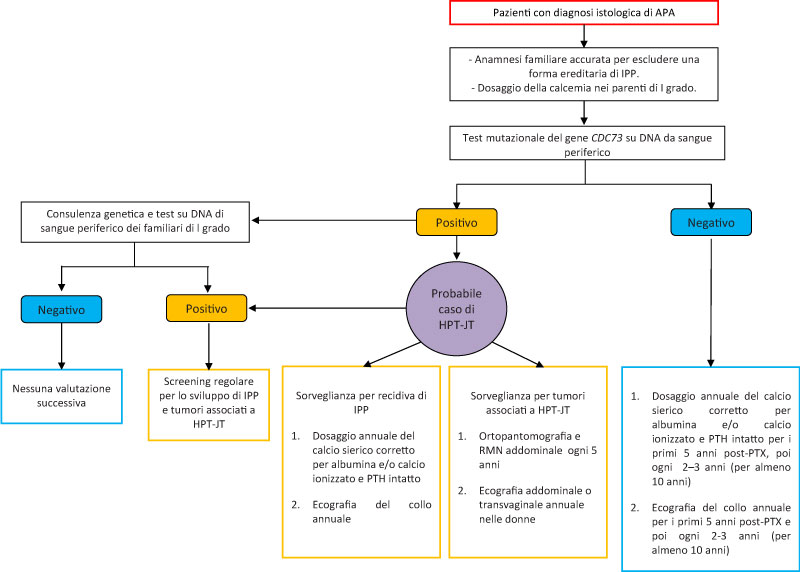
L’iter di monitoraggio del paziente con APA è sintetizzato nella Figura 2 [3]. Tutti i pazienti con APA dovrebbero eseguire l’analisi mutazionale germinale del gene CDC73. In caso di test negativo, il monitoraggio biochimico dei pazienti dovrebbe essere eseguito per almeno 10 anni dopo l’intervento insieme al controllo ecografico del collo. In caso di test genetico positivo, è opportuno eseguire uno screening strumentale per escludere i tumori associati a HPT-JT (tumori ossificanti della mandibola/mascella, uterini e lesioni renali). Inoltre, durante il follow-up è opportuno eseguire uno screening periodico per identificare eventuali recidive di IPP e/o la comparsa di tumori associati a HPT-JT. Il test genetico dovrebbe anche essere offerto ai familiari di primo grado anche se asintomatici.
Conclusioni
La diagnosi accurata di APA avviene nella fase post-operatoria sulla base del referto istologico. In casi rari, la diagnosi iniziale di APA viene convertita a diagnosi di PC in seguito alla comparsa di recidiva locale e/o metastasi a distanza durante il follow-up. La possibilità di escludere che un tumore paratiroideo con caratteristiche istologiche equivoche sia un PC è lo scopo primario del clinico che può così rassicurare il paziente che avrà uno scarso rischio di comparsa di una recidiva di IPP o metastasi.
Figura 1. Istopatologia dell’adenoma atipico delle paratiroidi (ematossilina-eosina). Immagine istologica rappresentativa di un adenoma atipico che mostra una crescita prevalentemente solida con spessi tralci fibrosi (A. Ingrandimento originale x4). In questo campo sono evidenti nidi neoplastici intrappolati nello spessore della capsula, cosiddetta “pseudo-invasione capsulare” (B. Ingrandimento originale x10, freccia). Spesso in queste neoplasie si verificano fenomeni emorragici spontanei, che evolvono in fibrosi riparativa con accumulo di macrofagi contenenti pigmento emosiderinico (C. Ingrandimento originale x10, freccia).
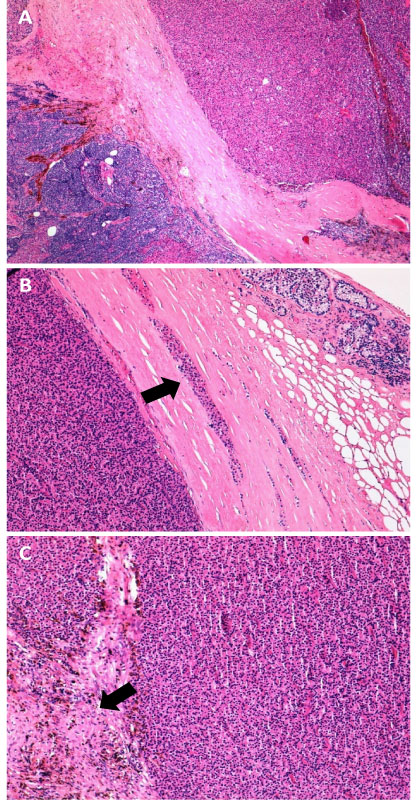 Figura 2. Algoritmo di monitoraggio per la gestione dei pazienti con adenoma atipico delle paratiroidi. APA, adenoma atipico delle paratiroidi; IPP, iperparatiroidismo primario; HPT-JT, iperparatiroidismo associato a tumori della mandibola/mascella; PTX, paratiroidectomia; RMN, risonanza magnetica nucleare.
Figura 2. Algoritmo di monitoraggio per la gestione dei pazienti con adenoma atipico delle paratiroidi. APA, adenoma atipico delle paratiroidi; IPP, iperparatiroidismo primario; HPT-JT, iperparatiroidismo associato a tumori della mandibola/mascella; PTX, paratiroidectomia; RMN, risonanza magnetica nucleare.
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione
umana
Studi sugli animali Gli autori non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Bilezikian JP, Bandeira L, Khan A et al. (2018) Hyperparathyroidism. Lancet 391: 168–178.
- DeLellis R, Larsson C, Arnold A et al. (2017) Tumors of the parathyroid glands. In WHO Classification of Tumors of Endocrine Organs, 4th ed.: 145–159. Eds R Lloyd, R Osamura, G Kloppel & J Rosai. Lyon, France: IARC Press.
- Saponaro F, Pardi E, Mazoni L et al. (2021) Do patients with atypical parathyroid adenoma need a close follow-up? J Clin Endocrinol Metab. Jun 22: dgab452.
- Cetani F, Marcocci C, Torregrossa L et al. (2019) Atypical parathyroid adenomas: challenging lesions in the differential diagnosis of endocrine tumors. Endocr Relat Cancer 26 (7):R441-R464.
- DeLellis RA (2008) Challenging lesions in the differential diagnosis of endocrine tumors: parathryoid carcinoma. Endocrine Pathology 19: 221–225.
- Brewer K, Costa-Guda J, Arnold A (2019) Molecular genetic insights into sporadic primary
hyperparathyroidism. Endocr Relat Cancer 26(2):R53-R72.
Scarica Articolo PDF



