Screening e Follow-up dei pazienti con mutazioni del gene MEN1
Alessio Ventroni1, Giorgia Zamboni2, Maria Vittoria Davi’2
1Medicina 1, Pistoia ASL, Toscana centro, Pistoia, Italia, 2UOS di Endocrinologia, Policlinico GB Rossi, ENETS Center of Excellence, Azienda Ospedaliera Universitaria Integrata, Verona, Italia Dipartimento di Scienze Mediche, Chirurgiche e Neuroscienze, Università degli Studi di Siena, Siena, Italia.
Autore corrispondente: MV Davi’ [email protected]
Introduzione
La neoplasia endocrina multipla tipo 1 (MEN1) è una rara sindrome ereditaria causata da mutazioni inattivanti del gene oncosoppressore MEN1 localizzato sul cromosoma 11q13. Le sue principali manifestazioni sono l’iperplasia/neoplasia delle paratiroidi, del sistema duodeno-pancreatico e dell’ipofisi che si presentano rispettivamente nel 90%, 30-70% e 30-40% dei casi entro i 40 anni d’età. Altri tumori endocrini che possono insorgere sono: carcinoidi bronchiali e timici (penetranza del 2% entro i 40 anni), tumori neuroendocrini (NET) gastrici (2%), tumori corticosurrenalici (40%), raramente feocromocitoma (<1%) (1,2). Tumori non endocrini associati alla MEN1 si possono sviluppare a carico del SNC (meningiomi), della cute (lipomi, angiofibromi e collagenomi), del muscolo liscio (leiomiomi) e della mammella (1-3).
Poiché’ non vi è una correlazione genotipo/fenotipo non è possibile prevedere l’espressione clinica della MEN1 nei familiari portatori la mutazione, anche se alcune mutazioni sembrano associate ad un comportamento più aggressivo. Sebbene manchino dati consistenti relativi alla popolazione giovanile, in una grande coorte comprendente 924 pazienti MEN1 il 17% aveva sviluppato tumori MEN1 correlati entro i 21 anni d’età. In questi pazienti l’iperparatiroidismo primitivo (IPTP) veniva diagnosticato nel 75% dei casi, adenomi ipofisari nel 34%, NET pancreatici (pNET) nel 34% (14% non funzionanti (NF), 12% insulinomi e 2% gastrinomi), adenomi surrenalici 1% e carcinoidi timici 1%. (4) Le neoplasie MEN1 correlate venivano diagnosticate già all’età di 5 anni (prolattinoma) sebbene la maggior parte venisse riscontrata dopo i 10 anni con un aumento della penetranza con l’avanzare dell’età.
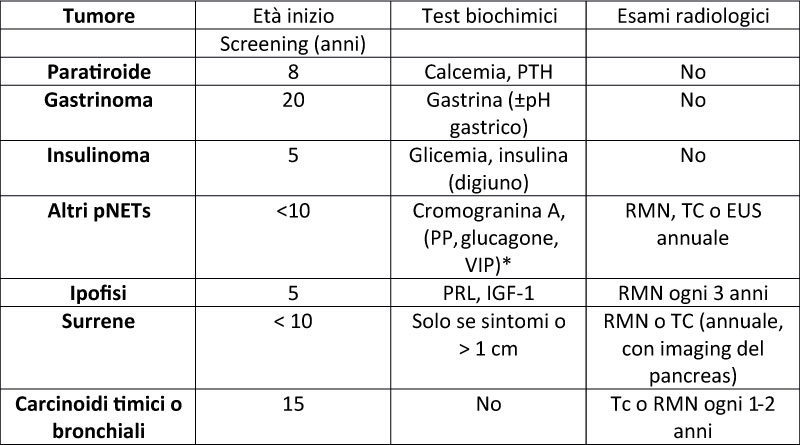
Le ultime linee guida dell’Endocrine Society della MEN1 ormai risalenti al 2012 raccomandano un programma di sorveglianza attiva dei pazienti portatori la mutazione MEN1 con esami biochimici e strumentali iniziando già all’età di 5 anni data la precocità di insorgenza delle manifestazioni (tabella 1). Il razionale di tale follow up intensivo di basa sul fatto che la diagnosi precoce e il trattamento delle sindromi endocrine e delle neoplasie in particolare i pNET e carcinoidi timici associati alla MEN1 possa ridurre la mortalità nei pazienti affetti.
Scopo di questo articolo è quello di illustrare il programma di sorveglianza di pazienti portatori la mutazione MEN1 secondo le più recenti linee guida.
Sorveglianza dei pazienti portatori la mutazione MEN1
Screening biochimico
Per quanto riguarda l’IPTP che è la manifestazione più frequente della MEN1 lo screening include il dosaggio della calcemia e PTH a partire dall’età di 8 anni, che è l’età più precoce alla quale si è manifestato.
Lo screening dei gastrinomi che sono i NET funzionanti più frequenti, soprattutto a sede duodenale, prevede il dosaggio della gastrina a partire dai 20 anni. In caso di aumento della gastrina, deve essere valutato il pH gastrico.
Lo screening dell’insulinoma invece comprende il dosaggio di glicemia e insulina dall’età di 5 anni che è l’età del caso sintomatico più precoce.
Per gli altri pNETs viene raccomandato il dosaggio di cromogranina A, polipeptide pancreatico (PP), glucagone e VIP iniziando all’età di 10 anni. Da sottolineare che PP, glucagone e VIP, pur essendo raccomandati nelle ultime linee guida, non sono tuttavia diffusamente disponibili nel territorio nazionale. Inoltre, la sensibilità diagnostica di tali ormoni nell’identificare precocemente i pNET non è chiaramente dimostrata. Infatti, studi retrospettivi hanno evidenziato che lo screening con dosaggio di cromogranina A, PP e glucagone, sia singolo che combinato, ha fallito nell’identificazione delle forme iniziali di pNET (3).
Per il dosaggio della cromogranina e gastrina, particolare attenzione deve essere rivolta ai falsi positivi, in particolare in caso di assunzione di inibitori di pompa protonica che dovrebbero essere sospesi almeno 10 giorni prima del prelievo.
Per quanto riguarda gli adenomi ipofisari, i principali ormoni da dosare sono PRL e IGF-1 a partire dai 5 anni di età, essendo i prolattinomi (20%), seguiti dai somatotropinomi (10%) i più frequenti. Lo screening ormonale delle neoplasie surrenaliche è raccomandato solo per adenomi surrenalici > 1 cm o associati a una clinica suggestiva.
Infine, per i carcinoidi timici e bronchiali non vengono consigliati marcatori biochimici specifici per lo screening perché’ la cromogranina A in questi casi è spesso normale se il tumore è di piccole dimensioni. Per le altre neoplasie le linee guida raccomandano di ripetere annualmente lo screening biochimico.
Una recente consensus internazionale di esperti promossa dalla Società Europea dei Tumori neuroendocrini (ENETS) riguardante la diagnosi e trattamento dei pNET e NET duodenali associati alla MEN1 ha proposto di ritardare all’età di 16 anni l’inizio dello screening nei pazienti asintomatici portatori la mutazione MEN1 poiché’ la maggior parte delle manifestazioni cliniche si presenta nella seconda decade d’età. Inoltre, secondo gli esperti l’intervallo di screening potrebbe essere dilazionato da 1 a 2-3 anni nei pazienti asintomatici. (5).
Diagnostica strumentale
RMN e TAC
Per quanto riguarda gli esami strumentali (tabella 1) in particolare dei pNET come pure delle neoplasie surrenaliche è raccomandata l’esecuzione di RMN o TAC addome con mdc anche se dovrebbe essere preferita la RMN rispetto alla TAC onde evitare l’esposizione a radiazioni ionizzanti visto che tale esame deve essere ripetuto annualmente (6). In alternativa alla TAC o RMN addome viene raccomandata l’esecuzione dell’ecoendoscopica che ha maggior sensibilità nell’individuare lesioni del pancreas in particolare della testa e corpo.
La RMN ipofisi viene raccomandata ogni 3 anni per lo screening degli adenomi ipofisari che nella maggior parte dei casi sono non funzionanti e pertanto possono dare segno di sé per effetto compressivo sul chiasma ottico o nervi cranici in caso di grandi dimensioni. Per lo screening dei carcinoidi polmonari/timici dovrebbe essere eseguita una TC o RMN toracica ogni 1-2 anni a partire dai 15 anni.
Indagini medico-nucleari
Le linee guida dell’Endocrine Society non raccomandano metodiche di medicina nucleare, in particolare Ga-PET-DOTATOC nello screening dei NET associati a MEN1. Secondo la recente consensus ENETS la Ga-PET-DOTATOC dovrebbe essere eseguita in presenza di pNET > 1 cm o in accrescimento per la stadiazione e/o per la valutazione della presenza dei recettori della somatostatina.
Essendo il rischio di progressione legato alle dimensioni, piccoli pNET NF < 2 cm possono essere seguiti in follow up in assenza di anamnesi familiare di pNET aggressivi, metastasi o segni di aggressività alla diagnostica per immagini.
Conclusioni
In conclusione, attualmente è dibattuto quale sia la strategia ottimale di sorveglianza di pazienti MEN1 in particolare l’età di inizio, l’intervallo dei controlli e le metodiche di diagnostica per immagini da utilizzare. Il follow up dovrebbe essere individualizzato sul singolo paziente in base ai sintomi, alle alterazioni biochimiche e alle caratteristiche del pNET in particolare le dimensioni iniziali, il tasso di crescita e se disponibile il grading del tumore. Data la natura indolente dei pNET < 2 cm, un follow up intensivo non sembra essere necessario.
Data la rarità e complessità della MEN1 è raccomandabile che questi pazienti vengano seguiti presso un centro di riferimento.
Tabella 1: Screening biochimico e radiologico dei tumori associati alla MEN1 nei pazienti affetti da MEN1 e nei portatori la mutazione MEN1 secondo le linee guida dell’Endocrine Society (2)
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione
umana
Studi sugli animali Gli autori non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C et al (2001) Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab 86:5658–5671. doi:10.1210/jcem.86.12.8070
- Thakker RV, Newey PJ, Walls GV et al (2012) Endocrine Society. Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1). J Clin Endocrinol Metab 9:2990-3011. doi: https://doi.org/10.1210/jc.2012-1230
- Kamilaris CDC, Stratakis CA (2019) Multiple Endocrine Neoplasia Type 1 (MEN1): An Update and the Significance of Early Genetic and Clinical Diagnosis. Front Endocrinol (Lausanne) Jun 11;10:339. doi:10.3389/fendo.2019.00339
- Goudet P, Dalac A, Le Bras M, Cardot-Bauters C, Niccoli P, Levy-Bohbot N et al (2015) MEN1 disease occurring before 21 years old: a 160-patient cohort study from the groupe d’etude des tumeurs endocrines. J Clin Endocrinol Metab Apr;100(4):1568-77. doi: 10.1210/jc.2014-3659
- Niederle B, Selberherr A, Bartsch DK, Brandi ML, Doherty GM, Falconi M, Goudet P, Halfdanarson TR, Ito T, Jensen RT et al (2021) Multiple Endocrine Neoplasia Type 1 and the Pancreas: Diagnosis and Treatment of Functioning and Non-Functioning Pancreatic and Duodenal Neuroendocrine Neoplasia within the MEN1 Syndrome - An International Consensus Statement. Neuroendocrinology 111(7):609-630. doi: https://doi.org/10.1159/000511791
- van Treijen MJC, van Beek DJ, van Leeuwaarde RS, Vriens MR, Valk GD (2018) Diagnosing Nonfunctional Pancreatic NETs in MEN1: The Evidence Base. J Endocr Soc. Jul 31;2(9):1067-1088. doi: 10.1210/js.2018-00087.
Scarica Articolo PDF


