Sorveglianza vs terapia adiuvante del carcinoma corticosurrenalico: nuovi fattori prognostici
Anna Calabrese. Vittoria Basile, Soraya Puglisi, Annarosa Pia, Massimo Terzolo.
Dipartimento di Scienze Cliniche e Biologiche, Università degli Studi di Torino, Ospedale San Luigi Gonzaga, Orbassano, Torino, Italia
Autore Corrispondente: terzolo@usa.net
Introduzione
Il carcinoma surrenalico ha un’incidenza che oscilla tra lo 0.7-2 casi/milione/anno. Il primo approccio è il trattamento chirurgico, eseguito in centri ad elevato livello di expertise in chirurgia oncologica surrenalica. Il decorso della malattia può essere molto variabile ed eterogeneo ma la prognosi è generalmente sfavorevole, con un tasso di recidiva che si attesta al 60% circa1. Per tale motivo nelle ultime decadi la comunità scientifica si è adoperata a studiare i possibili benefici derivanti dall’introduzione della terapia adiuvante dopo la prima chirurgia Secondo le ultime Linee Guida della Società Europea di Endocrinologia (ESE), i fattori che influiscono negativamente sulla sopravvivenza libera da recidiva e globale sono un elevato stadio alla diagnosi, la secrezione di cortisolo e un elevato Ki671-4.
Metodo di stadiazione ENSAT
Attualmente il più diffuso metodo di stadiazione tumorale è la classificazione ENSAT (European Network for the Study of Adrenal Tumors) che comprende quattro livelli: stadio I-II, tumore confinato alla loggia surrenalica; stadio III, tumore localmente avanzato (linfonodi positivi e/o infiltrazione degli organi circostanti e dei vasi sanguigni); stadio IV, metastasi a distanza. La sopravvivenza a 5 anni è del 60-80%, 35-50% e 0-28% rispettivamente. È stata recentemente proposta una sotto classificazione che meglio definisce la prognosi del paziente in stadio avanzato: IVa, IVb e IVc con rispettivamente 2, 3 o più metastasi adistanza. I tassi di sopravvivenza a 5 anni sono del 15%, 14% e 2%, rispettivamente2.
Nuovi fattori prognostici
Una metanalisi ha mostrato come la secrezione ormonale e di cortisolo in particolare, siano fattori prognostici negativi indipendenti dalla stadiazione tumorale. Infatti, l’eccesso di cortisolo ha un effetto sfavorevole nei confronti del sistema immunitario e cardiovascolare, ed inoltre, recenti studi di trascrittomica hanno individuato un comportamento più aggressivo in questo sottogruppo di tumori. La secrezione di androgeni invece non è chiaramente associata ad una peggior prognosi, ma i dati sono limitati e per questo non sono possibili valutazioni conclusive3. In ogni caso, alla diagnosi tutti i pazienti dovrebbero essere sottoposti ad una valutazione ormonale completa per identificare la secrezione di glucocorticoidi, ormoni sessuali, mineralocorticoidi e precursori steroidei.
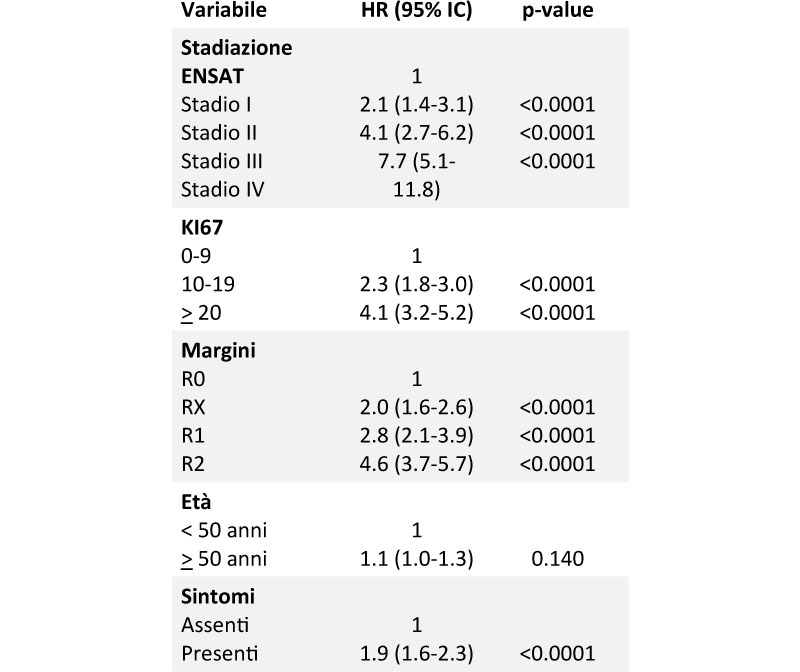
Nel 2015 uno studio multicentrico ha elaborato un sistema a punteggio per valutare la prognosi del paziente, chiamato GRAS score, che si basa su grading (Weiss Score >6 e/o Ki67 >20%), resezione dei margini, età e sintomi legati alla massa o secrezione tumorale. Nell’anno corrente è stato pubblicato uno studio multicentrico nel quale è stato proposto un nuovo score chiamato S-GRAS che prende in considerazione oltre ai parametri già citati anche lo stadio tumorale, dando maggior peso a quest’ultimo, alla resezione dei margini e al Ki67, mentre non viene più considerato il Weiss score come parametro (Tabella 1). Dalle analisi emerge che lo score predice meglio la sopravvivenza rispetto ai singoli parametri sia per la progression free survival (PFS) che per la disease specific survival (DDS)5.
Ricadute nella pratica clinica
Ma come questi fattori ci aiutano nella pratica clinica? Un’accurata valutazione della prognosi ci permetterebbe di pianificare il trattamento adiuvante e le visite di follow up, dal momento che attualmente la programmazione è standardizzata sia per i pazienti che dopo la chirurgia avviano una terapia adiuvante sia per coloro che sono sottoposti alla semplice sorveglianza. Inoltre, consentirebbe di impostare un più adeguato counseling con il paziente.
Attualmente le Linee Guida raccomandano il trattamento adiuvante con mitotane nei pazienti ad alto rischio di recidiva (stadio III, coinvolgimento dei margini di resezione, o stato dei margini non noto, Ki67
>10%), mentre per il rischio basso o moderato non vi sono evidenze sufficienti a stabile una raccomandazione. Viene citata come possibilità la radioterapia adiuvante nei pazienti in stadio III e coinvolgimento dei margini, o stato dei margini non noto, e la chemioterapia adiuvante nei pazienti a rischio molto elevato di recidiva1.
Dalle metanalisi che seguono queste raccomandazioni viene mostrato come la terapia adiuvante con mitotane abbia un beneficio in termini di sopravvivenza libera da recidiva (HR medio 0.7, 95% CI: 0.5–1.1) e sopravvivenza globale (HR medio 0.7, 95% CI: 0.5–0.9); mentre la radioterapia adiuvante ottiene un beneficio soprattutto sulla sopravvivenza libera da recidiva (HR medio 0.8, 95% CI: 0.6–1.1) che sulla
sopravvivenza globale (HR medio 1.0, 95% CI: 0.7–1.5)1.
Nello studio citato precedentemente, è stata effettuata un’analisi retrospettiva sul gruppo di pazienti che hanno effettuato la terapia adiuvante con mitotane: ciò che è stato osservato è che alcune categorie come stadio III, Ki67 > 20% e più in generale i pazienti che hanno un S-GRAS score intermedio sono coloro che beneficiano maggiormente della terapia adiuvante con mitotane5.
Conclusioni
Concludendo, fattori prognostici come lo stadio, il Ki67, i margini di resezione, l’età e i sintomi legati alla secrezione ormonale, possono quindi aiutarci a scegliere e rendere la sorveglianza e il trattamento adiuvante sempre più adattati alle caratteristiche del tumore e alle esigenze del paziente.
Tabella 1
Analisi univariata dei singoli parametri che compongono il S-GRAS score rapportati alla progression freesurvival (PFS). Dati tratti da “S-GRAS score for prognostic classification of adrenocortical carcinoma: an international, multicenter ENSAT study”.
Conflitti di interesse Gli autori dichiarano di non avere conflitti di interesse
Consenso informato Lo studio presentato in questo articolo non ha richiesto sperimentazione umana
Studi sugli animali Gli autori di questo articolo non hanno eseguito studi sugli animali
Riferimenti bibliografici
- Fassnacht M, Dekkers OM, Else T, Baudin E, Berruti A, de Krijger R, Haak HR, Mihai R, Assie G, Terzolo M. European Society of Endocrinology Clinical Practice Guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018 Oct 1;179(4):G1-G46. doi: 10.1530/EJE-18-0608.
- Libé R, Borget I, Ronchi CL, Zaggia B, Kroiss M, Kerkhofs T, Bertherat J, Volante M, Quinkler M, Chabre O, Bala M, Tabarin A, Beuschlein F, Vezzosi D, Deutschbein T, Borson-Chazot F, Hermsen I, Stell A, Fottner C, Leboulleux S, Hahner S, Mannelli M, Berruti A, Haak H, Terzolo M, Fassnacht M, Baudin E; ENSAT network. Prognostic factors in stage III-IV adrenocortical carcinomas (ACC): an European Network for the Study of Adrenal Tumor (ENSAT) study. Ann Oncol. 2015 Oct;26(10):2119-25. doi: 10.1093/annonc/mdv329.
- Vanbrabant T, Fassnacht M, Assie G, Dekkers OM. Influence of hormonal functional status on survival in adrenocortical carcinoma: systematic review and meta-analysis. Eur J Endocrinol. 2018 Dec 1;179(6):429-436. doi: 10.1530/EJE-18-0450.
- Beuschlein F, Weigel J, Saeger W, Kroiss M, Wild V, Daffara F, Libé R, Ardito A, Al Ghuzlan A, Quinkler M, Oßwald A, Ronchi CL, de Krijger R, Feelders RA, Waldmann J, Willenberg HS, Deutschbein T, Stell A, Reincke M, Papotti M, Baudin E, Tissier F, Haak HR, Loli P, Terzolo M, Allolio B, Müller HH, Fassnacht M. Major prognostic role of Ki67 in localized adrenocortical carcinoma after complete resection. J Clin Endocrinol Metab. 2015 Mar;100(3):841-9. doi: 10.1210/jc.2014-3182.
- Elhassan YS, Altieri B, Berhane S, Cosentini D, Calabrese A, Haissaguerre M, Kastelan D, Fragoso MCBV, Bertherat J, Al Ghuzlan A, Haak H, Boudina M, Canu L, Loli P, Sherlock M, Kimpel O, Laganà M, Sitch AJ, Kroiss M, Arlt W, Terzolo M, Berruti A, Deeks JJ, Libé R, Fassnacht M, Ronchi CL. S-GRAS score for prognostic classification of adrenocortical carcinoma: an international, multicenter ENSAT study. Eur J Endocrinol. 2021 Nov 30;186(1):25-36. doi: 10.1530/EJE-21-0510.
Scarica Articolo PDF