Introduzione
L’iperplasia surrenalica bilaterale è una rara causa di sindrome di Cushing (CS) e rappresenta circa il 10-15% delle forme surrenaliche di CS; si divide in micro - e macronodulare a seconda delle dimensioni minori o maggiori di 1 cm dei nodi surrenalici.
Indipendentemente dalle loro caratteristiche macroscopiche, le forme micro- e macronodulari presentano una disregolazione della via di segnale relativa a cAMP/protein kinasi A (PKA), regolato dall’ACTH[1].
Iperplasia surrenalica micronodulare
Malattia nodulare pigmentosa primaria della corteccia surrenale (PPNAD) e malattia surrenalica micronodulare isolata (IMAD)
PPNAD è caratterizzata da surreni di dimensioni normali o lievemente ingrandite, con nodi surrenalici bilaterali < 10mm, circondati da tessuto surrenalico atrofico. È una causa rara di CS ACTH-indipendente e si può trovare in forma sporadica o all’interno del complesso di Carney (CNC). Il CNC, a trasmissione autosomica dominante, è caratterizzato dalla presenza di malformazioni cutanee ed iperpigmentazione mucosale, mixomi e neoplasie di origine endocrina o non endocrina. La mutazione germinale del gene PRKAR1A è presente nell’80% dei pazienti. PRKAR1A codifica per la subunità regolatoria 1a della PKA, responsabile del segnale surrenalico del cAMP.
IMAD è caratterizzata da iperplasia del tessuto surrenalico intranodulare e assenza di pigmentazione. Sono state identificate mutazioni inattivanti del gene PDE11A, la cui mutazione comporta iperattivazione del pathway cAMP/PKA con conseguente iperproliferazione cellulare ed ipercortisolismo[1].
Iperplasia surrenalica bilaterale macronodulare (BMAH)
Si tratta di una forma rara di CS caratterizzata dalla presenza di nodi surrenalici bilaterali > 10mm. La diagnosi avviene in genere intorno alla 5-6 decade di vita in quanto la crescita dei nodi surrenalici si verifica lentamente nel tempo, inoltre vi è un’importante eterogeneità fenotipica, che può variare da forme subcliniche a floride[1].
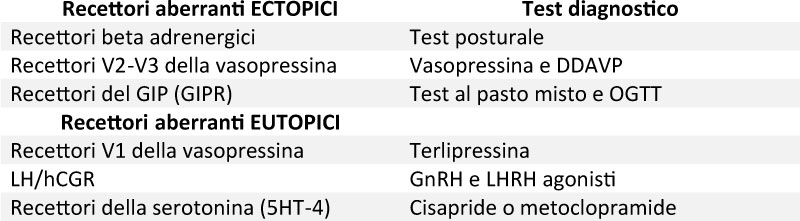
Nella maggioranza dei casi di BMAH è stata identificata a livello surrenalico l’espressione aberrante di recettori accoppiati a proteine G, ectopici o eutopici, che rispondono a ligandi diversi dall’ACTH, o all’azione autocrina-paracrina dell’ACTH, con conseguente iperattivazione del pathway cAMP/PKA e stimolazione della steroidogenesi (Tabella I)[1].
Tabella 1 Recettori aberranti espressi a livello surrenalico [2]
Nel 25-50% dei pazienti affetti da iperplasia surrenalica bilaterale macronodulare è stata identificata la mutazione di ARMC5, gene oncosoppressore responsabile della regolazione della steroidogenesi surrenalica in senso pro-apoptotico e di controllo negativo sulla proliferazione cellulare clonale. La tumorigenesi segue il modello del doppio hit[1]. L’inattivazione di ARMC5 comporta una steroidogenesi surrenalica inefficace, tuttavia l’ipercortisolismo si verifica a seguito del notevole incremento dimensionale del tessuto surrenalico [2]. È stata messa in evidenza un’associazione tra la mutazione di ARMC5 e lo sviluppo di meningiomi intracranici, pertanto la TC cerebrale è suggerita nei carrier [3].
Recentemente è stata identificata la mutazione di KDM1A, oncosoppressore la cui ridotta attività comporta l’espressione ectopica di GIPR con conseguente ipercortisolismo pasto-dipendente. KDM1A è inoltre implicato nelle forme familiari di mieloma multiplo [4], [5]. Le forme di CS pasto dipendente si differenziano dalle forme di ipersecrezione cronica di cortisolo poiché in tali casi la secrezione di cortisolo aumenta in risposta al pasto, a seguito dell’incremento postprandiale dei livelli di GIP. Livelli ridotti di cortisolo plasmatico al mattino caratterizzano tali forme, dovuti alla ridotta secrezione di GIP a digiuno, e alla soppressione dei livelli di CRH ed ACTH a seguito dell’ipercortisolismo presente durante l’arco della giornata. L’asse ipotalamo-ipofisi in questi pazienti può non essere del tutto soppresso, data la secrezione cortisolo intermittente pasto dipendente. [6]
In merito all’espressione di recettori illeciti nei pazienti con mutazione di ARMC5, in nessun caso è stata riscontrata una forma di CS pasto-dipendente, ovvero secondaria all’espressione di recettori per il GIP, mentre è stata riscontrata con maggior frequenza la risposta del cortisolo al test posturale; questo aspetto mette in evidenza il fatto che BMAH è secondaria a diverse cause genetiche, verosimilmente associate ad uno specifico pattern di recettori illeciti [3].
Inoltre BMAH viene talvolta riscontrata come parte di sindromi neoplastiche multiple dovute ad alterazioni dei geni APC, Menina e Fumarato Hydratasi [2].
Figura 1 Iperplasia surrenalica micronodulare
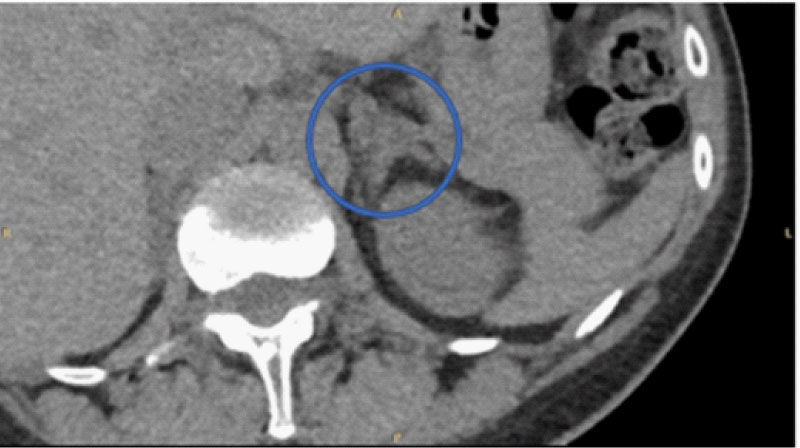 Figura 2 Iperplasia surrenalica macronodulare
Figura 2 Iperplasia surrenalica macronodulare
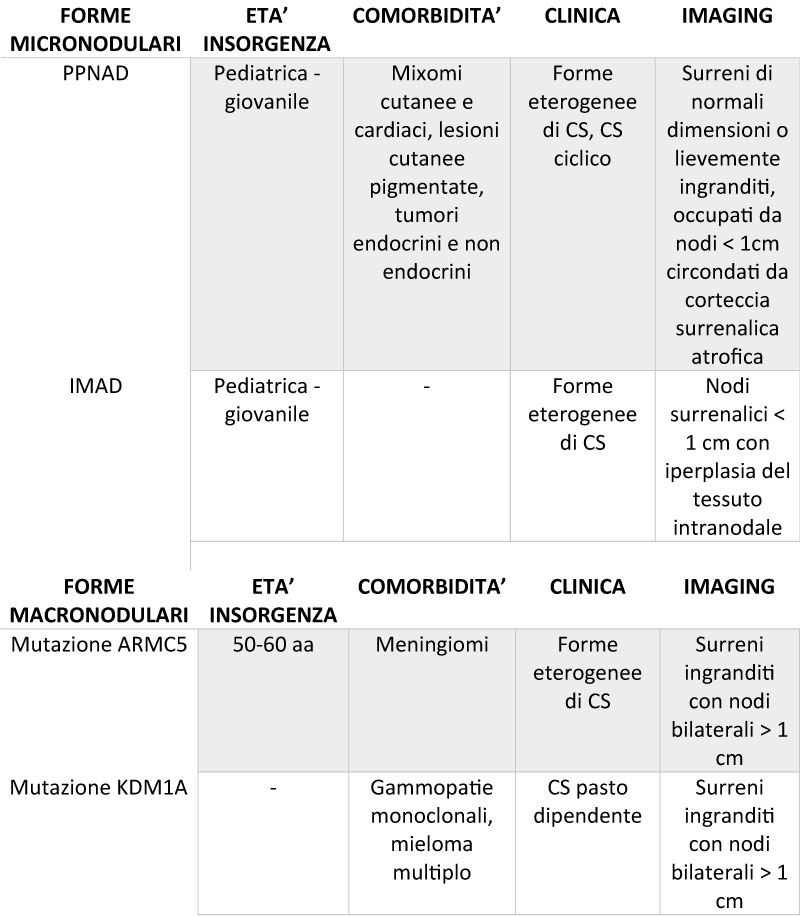
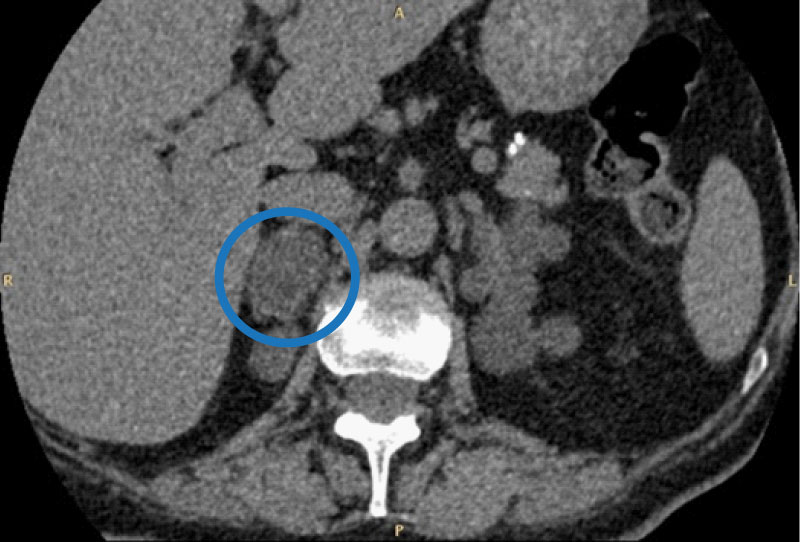 Tabella 2 Forme micro e macronodulari a confronto
Tabella 2 Forme micro e macronodulari a confronto
 Conclusioni
Conclusioni
Nei pazienti con forme bilaterali di iperplasia surrenalica è importante identificare tali alterazioni genetiche, al fine di un corretto approccio diagnostico-terapeutico e per la gestione delle eventuali comorbidità che caratterizzano il quadro (meningiomi cerebrali per ARMC5 e gammopatia monoclonale per KDM1A) [3], [4].
Inoltre tale aspetto è rilevante per una corretta indagine sui familiari, al fine di poter formulare una diagnosi precoce ed un trattamento tempestivo finalizzato a ridurre le complicanze cortisolomediate [1].
.





